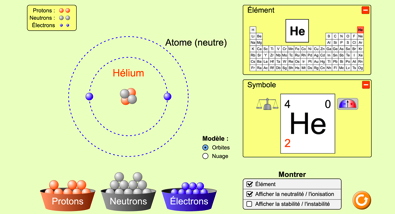
Atome








Nous avons vu que la matière est constituée de petits grains qu’on appelle des atomes. Ils sont si petits qu’on ne les voit ni à l’oeil nu ni avec un microscope “normal”.
Si une goutte d’eau avait la taille de la Terre,
Un atome aurait la taille d’un homme.
On peut visualiser les atomes au moyen d’appareils compliqués comme le microscope électronique. On découvre alors que la matière a une structure différente de ce que l’on voit à l’oeil nu.
Constitution de l’atome
Tous les atomes sont constitués de 3 particules encore plus petites qui ont des propriétés différentes:
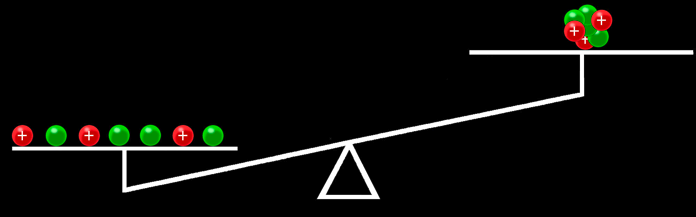
Puisque le proton et le neutron ont une masse très voisine et environ 1800 fois plus grande que celle de l’électron, on peut simplifier le tableau qui devient:
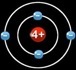
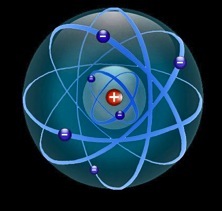
Les protons et les neutrons sont des nucléons: ils forment le noyau de l’atome autour duquel tournent les électrons. La masse de l’atome est pratiquement concentrée dans le noyau.
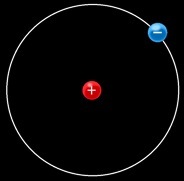
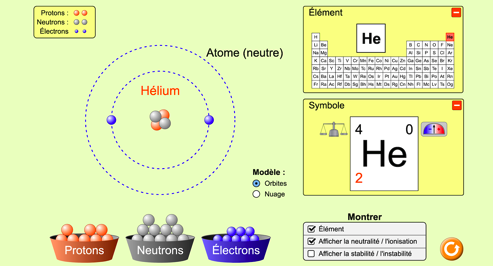
Prenons un atome d’hydrogène: il est formé d’un électron chargé négativement (-) qui “toune autour” dun proton chargé positivement (+)
Dans l’écriture courante, on symbolise l’hydrogène
La valeur de la masse atomique est arrondie à 1. En effet la valeur de la masse atomique (1,008) est une moyenne de la masse d’une population d’atomes. Et ils ne sont pas tous pareils. Nous y reviendrons prochainement.
D’autres exemples:
= symbole du carbone
= 6 protons et 6 électrons
= 12 nucléons soit 6 protons + 6 neutrons
C
6
12
Na
11
23
= symbole du sodium (natrium en allemand)
= 11 protons et 11 électrons
= 23 nucléons soit 11 protons + 12 neutrons
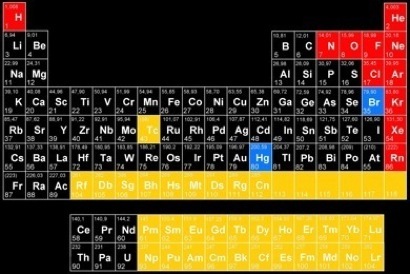
Les éléments
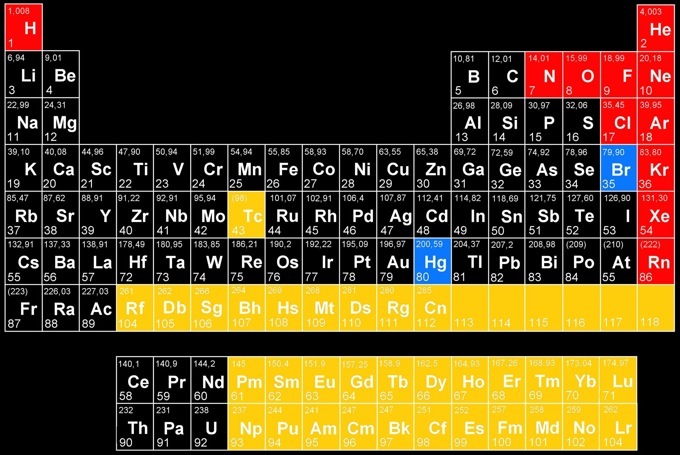
Les éléments sont des atomes qui possèdent le même numéro atomique N. Ils ont le même nombre d’électrons (donc nous le verrons les mêmes propriétés chimiques).
On désigne les éléments par des symboles, généralement tirés du nom français:
= bore
= calcium
= fluor
= fer
= zinc
= oxygène
B
Ca
F
Fe
Zn
O
Certains symboles viennent d’une autre langue:
Na
K
W
Au
Hg
Sn
Sb
N
= sodium (allemand: natrium)
= potassium (allemand: kalium)
= tungstène (allemand: wolfram)
= or (latin: aurum)
= mercure (latin: hydrargyrum)
= étain (latin: stannum)
= antimoine (latin: stibium)
= azote (vieux français: nitrogène)
Les isotopes
Les atomes qui ont le même numéro atomique mais un nombre de masse différent sont les isotopes d’un même élément.
Exemple:
Dans une population d’atomes d’hydrogène, on en trouve 3 différents:
hydrogène
deutérium
tritium
Ce sont les 3 isotopes de l’hydrogène
Ils ont des propriétés chimiques semblables (chaque atome a 1 électron pour se lier) mais des propriétés physiques différentes, leur masse étant dans un rapport 1 : 2 : 3
sont 3 isotopes du carbone. Le carbone 14 est radioactif (*). Il est instable parce que “trop lourd”: il se désintègre en émettant un rayonnement (radio = rayon).
L’énergie nucléaire
C’est l’énergie qui est contenue dans le noyau (du latin: nucleus). Nous avons vu que le noyau est formé de particules neutres ou chargées positivement. La stabilité des noyaux, formés de protons qui normalement se repoussent violemment, s’explique par des forces nucléaires de liaison des nucléons.
Petite expérience virtuelle: fabriquons un atome de lithium à partir de ses constituants:
Au moment où les noyaux se forment à partir des nucléons isolés, on assiste à la disparition d’une certaine quantité de matière: c’est le défaut de masse. Cette matière se transforme en énergie selon la célèbre formule:
Plus l’énergie émise est grande, plus l’énergie de liaison des nucléons est grande, plus le noyau est stable.
C’est cette énergie considérable qui est mise en jeu dans les réactions de :
•
•
Ces réactions sont souvent accompagnées d’émissions de rayons électromagnétiques. L’activité de ces rayons (= “radio”) permet de comprendre la radioactivité. Nous les reverrons plus loin.
longues ondes
•
•
basse fréquence
énergie faible
ondes courtes
•
•
haute fréquence
énergie élevée
Suite du cours: structure de l’atome



Retour au portail de chimie


Retour au portail des sciences


















solide
liquide
gaz
artificiel



Masse atomique
= nombre de nucléons
(protons + neutrons)
numéro atomique
= nombre de protons dans le noyau
= nombre d’électrons dans l’enveloppe électronique
symbole de l’élément
“H” pour hydrogène







ou


ou
Nom
Hydrogène
Hélium
Lithium
Beryllium
Bore
Carbone
Azote
Oxygène
Fluor
Néon
Sodium
Magnésium
Aluminum
Silicium
Phosphore
Soufre
Chlore
Argon
Potassium
Calcium
Scandium
Titane
Vanadium
Chrome
Manganèse
Fer
Cobalt
Nickel
Cuivre
Zinc
Gallium
Germanium
Arsenic
Sélénium
Brome
Krypton
Rubidium
Strontium
Yttrium
Zirconium
Niobium
Molybdène
Technetium
Ruthenium
Rhodium
Palladium
Argent
Cadmium
Indium
Etain
Antimoine
Tellure
Iode
Xénon
Césium
Barium
Lanthane
Cerium
Praséodyme
Symbole
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Ce
Pr
N
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
Nom
Neodyme
Promethium
Samarium
Europium
Gadolinium
Terbium
Dysprosium
Holmium
Erbium
Thulium
Ytterbium
Lutetium
Hafnium
Tantale
Tungstène
Rhenium
Osmium
Iridium
Platine
Or
Mercure
Thallium
Plomb
Bismuth
Polonium
Astate
Radon
Francium
Radium
Actinium
Thorium
Protactinium
Uranium
Neptunium
Plutonium
Americium
Curium
Berkelium
Californium
Einsteinium
Fermium
Mendelevium
Nobelium
Lawrencium
Rutherfordium
Dubnium
Seaborgium
Bohrium
Hassium
Meitnerium
Darmstadtium
Roentgenium
Copernicium
Ununtrium
Flérovium
Ununpentium
Livermorium
Ununseptum
Ununoctium
Symbole
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
Cn
Uut
Fl
Uup
Lv
Uus
Uuo
N
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
116
117
118



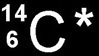














C’est le principe d’équivalence entre la masse et l’énergie.



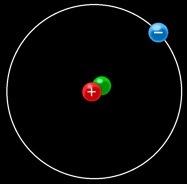
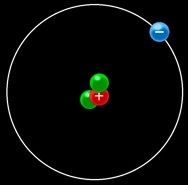
A chaque élément est associé un symbole (une lettre majuscule parfois suivie d'une minuscule). On peut classer les éléments selon leur numéro atomique N.
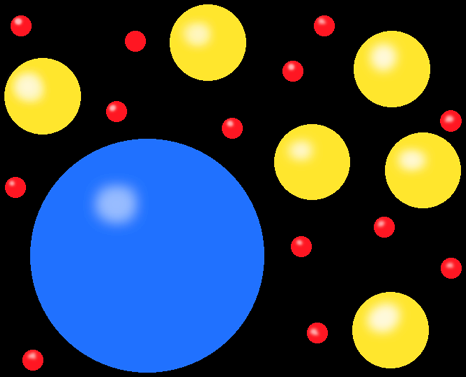
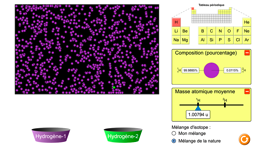
L’univers est composé de milliards de milliards de milliards d’atomes, mais il n’existe qu’une centaine de types d’atomes différents: une centaine d’éléments.
Dans cette image j’ai représenté 20 atomes. Mais il n’y a que 3 sortes d’atomes différents, avec des propriétés (taille, couleur) différentes: ce sont 3 éléments différents.

Fission d’atomes “lourds” (centrale nucléaire, bombe A). Lors d’une fission, des gros noyaux atomiques “se cassent” pour en donner de plus petits.
Fusion d’atomes “légers” (fusion de l’hydrogène dans le soleil, bombe H). Lors d’une fusion, plusieurs petits noyaux atomiques “se collent” pour en donner un plus gros.


Trouve le nom des éléments C _ Na _ He _ H _ N _ O _ U _ K _
Combien d'électrons y a-t-il dans les atomes de C _ H _ N _ O _ U _ K _
Qu’ont en commun les éléments d'une colonne du tableau périodique?
1.
2.
3.
feuille d’aluminium
atomes d’aluminium





électron
proton
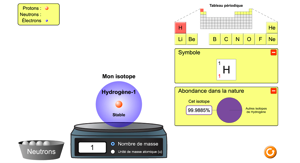
L’hydrogène est le premier et le plus simple élément du tableau périodique.


Animation «isotopes»
Animation «masse atomique»

Une animation permet de «construire des atomes»