Le benzène et ses dérivés


b) Substituants « méta-orienteurs » : DESACTIVENT


hydrocarbures benzéniques
Le radical s’appelle phenyle
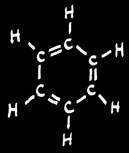
Les C sont hybridés SP2 : il y a un nuage d’électrons π délocalisés de part et d’autre du plan de la molécule.
Représentation symbolique :
Les 6 liaisons du benzène sont identiques.
La vision du benzène comme celle-ci est donc trop simple: ou
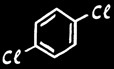
Paradichlorobenzène
( p . dichlorobenzène )
1,4 dichlorobenzène

Nomenclature

Etat naturel
Principaux dérivés du benzène
Isomérie
Dans le pétrole et les charbons. Découvert en 1825 par Faraday dans les produits de distillation de la houille.


Réactivité
Préparation



=
=
benzène
phenol
acide benzoïque
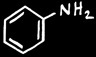
aniline
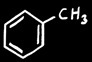
toluène
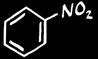
nitrobenzène
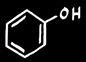
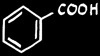

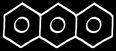
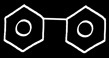
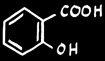

acide salicylique
naphtalène
antracène
diphényle
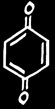
quinone
o . xylène
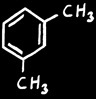
m . xylène
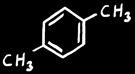
p . xylène
( voir isomérie après )
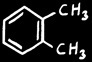
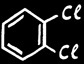
Orthodichlorobenzène
( o . dichlorobenzène )
1,2 dichlorobenzène
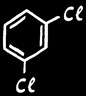
Métadichlorobenzène
( m . dichlorobenzène )
1,3 dichlorobenzène
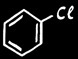
chlorobenzène

Il faut imaginer un modèle dans lequel les électrons π des doubles liaisons sont délocalisés:
La perpétuelle rotation de ce nuage électronique se symbolise par :

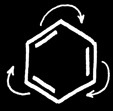


La rotation du nuage électronique n’est possible que s’il y a alternance entre simples et doubles liaisons dans un cycle. De plus, cette rotation entraîne une perte d’énergie (donc gain de stabilité): toutes réactions entraînant une destruction de l’alternance simple/double liaison (additions) ne se fera donc que difficilement.



Fin de la page
Suite du cours: Thermochimie




Retour au portail des sciences

Retour au portail de chimie






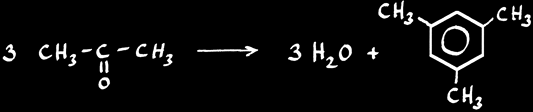


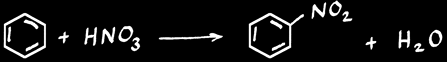
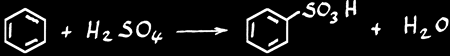
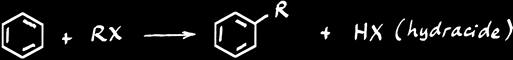
Par cyclisation des cétones
C.
A.
B.
1,3,5-Triméthyl benzène
A partir d’un cyclohexane par déshydrogénation .
Houille chauffage à l’abri de l’air coke + gaz ( CH4, H2 , C2H6 … ) + goudrons contenant du benzène.
Par carbonisation de la houille (dégazage)
Exemples:

Contrairement aux alcènes, le benzène ne fait pas de réaction d’addition (à cause de l’ouverture des doubles liaisons) mais des substitutions !!
ça marche !
destruction du cycle benzénique: réaction peu probable !
Exemples:
1.
2.
3.
4.
halogénation :
nitration :
sulfonation :
alkylation :
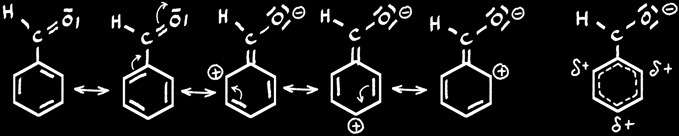
Si l’on applique une de ces réactions sur un cycle qui comporte déjà un radical, on n’obtient pas dans chaque cas les 3 isomères ortho, méta, para. L’orientation dépend du radical déjà en place.
a) Les substituants « ortho / para orienteurs » : ACTIVENT

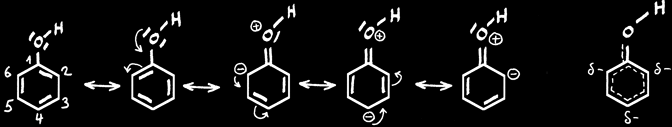

Les carbones 2, 4 et 6 ont une densité électronique plus grande et sont plus réactifs que les autres (substitutions électrophiles) à réactions rapides.
Les carbones 2, 4 et 6 sont déficitaires en électrons. Comme le benzène fait des réactions de substitutions électrophiles, les C 2, 4 et 6 sont désactivés par rapport au C3 et C5: la substitution se fera préférentiellement sur les carbones 3 et 5 et lentement !