Chimie du calcaire
















CaCO3 + 2 HCl ----> CaCl2 + H2CO3

Le calcaire réagit avec l’acide chlorhydrique pour former un sel (le chlorure de calcium CaCl2 ) et de l’acide carbonique H2CO3 . On écrit l’équation:
Mais l’acide carbonique H2CO3 est instable à TPN (température et pression normale). La molécule “se casse” pour former de l’eau et du gaz carbonique qui s’échappe en faisant des bulles:
H2CO3 ----> H2O + CO2
Cette réaction est très utile pour reconnaître une roche calcaire sur le terrain. Le géologue emporte toujours avec lui une petite bouteille d’acide chlorhydrique pour analyser les roches.




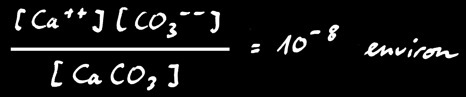


Solubilité du calcaire
Le calcaire est un sel. En solution aqueuse (dans l’eau), il peut se dissocier et former des ions.
Mais comme le calcaire est très peu soluble, cette réaction n’a pratiquement pas lieu. En effet si on écrit la loi d’action de masse:
Par contre le calcaire se dissous facilement en présence d’acide. Le gaz carbonique contenu dans l’air réagit avec l’eau pour former de l’acide carbonique H2CO3.
Celui-ci réagit avec le carbonate insoluble pour former l’ion hydrogénocarbonate (ou bicarbonate) qui est soluble dans l’eau.

Réaction avec l’acide
Le calcaire est une roche sédimentaire composée de carbonate de calcium CaCO3.
2.
1.



Suite du cours: l’électronégativité
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: Acides et bases



Suite du cours: les solutions



Lorsqu’on verse quelques gouttes d’acide chlorhydrique HCl,
la roche se met à mousser (on parle d’effervescence).





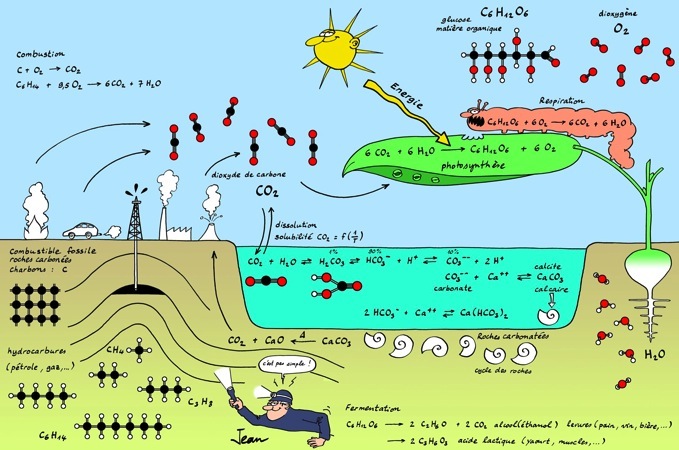
Le cycle du carbone


bicarbonate de calcium
(soluble dans l’eau)

carbonate de calcium
(presque insoluble)

C’est sous cette forme qu’on le trouve dans l’eau de boisson:


«Gouffres et grottes», un film de la série «C’est pas sorcier»






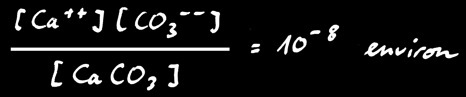

Formation du calcaire
Mais comme le calcaire est très peu soluble, cette réaction n’a pratiquement pas lieu. En effet si on écrit la loi d’action de masse:
Le calcaire se dissous facilement en présence d’acide. Le dioxyde de carbone (gaz carbonique) contenu dans l’air réagit avec l’eau pour former de l’acide carbonique H2CO3.
Celui-ci réagit avec le carbonate insoluble pour former l’ion hydrogénocarbonate (ou bicarbonate) qui est soluble dans l’eau.
bicarbonate de calcium
(soluble dans l’eau)

carbonate de calcium
(presque insoluble)



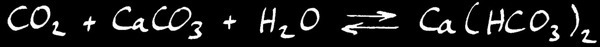


échange avec l’atmosphère
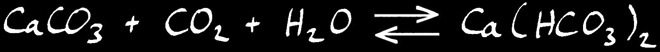
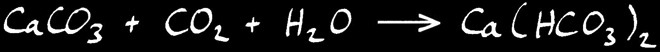
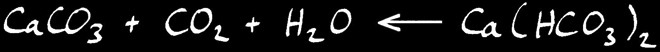



apport de CO2
atmosphérique



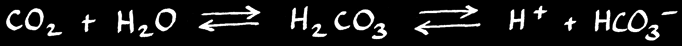
acide carbonique



Une partie du dioxyde de carbone CO2 dissout dans l’eau peut réagir avec elle pour former de l’acide carbonique H2CO3. Celui-ci peut à son tour se dissocier pour former des ions hydrogénocarbonate HCO3- et H+ .
ion
hydrogénocarbonate
Certains animaux aquatiques utilisent l’ion hydrogénocarbonate pour fabriquer leur squelette ou leur coquille calcaire.
calcaire
Lorsque ces animaux meurent, leur coquille calcaire tombe au fond de l’eau. Le calcaire est un sel. En solution aqueuse (dans l’eau), il peut se dissocier et former des ions.
Les coquilles s’entassent donc au fond de l’eau : c’est la sédimentation. Après un long processus (diagenèse), le sédiment se transforme en une roche calcaire solide dans laquelle on peut retrouver des traces d’anciennes coquilles: des fossiles.


L’imposante paroi des Gastlosen dans les Alpes fribourgeoises (Suisse), est formée de sédiments calcaires.
La carrière de marbre, Carrare (Italie)

Altération du calcaire
production de calcaire
dissolution du calcaire
Le ruissellement de l’eau de pluie légèrement acide à la surface des roches calcaires crée des rigoles de dissolution typiques des paysages karstiques. On appelle «lapiaz» ce genre de structures. Ci-dessous le lapiaz du glacier de Tsanfleuron dans le massif des Diablerets (Suisse).


Métamorphisation du calcaire
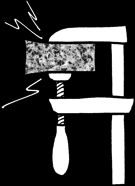

Lorsque le calcaire est soumis à une forte pression et/ou à une élévation importante de température, les cristaux de calcite se réarrangent: le calcaire se transforme (on dit «se métamorphise» en marbre.

échantillon de marbre, Paros (Grèce)
Il arrive aussi que le calcaire réagisse avec la silice SiO2 sous l’effet de la pression et de la température pour former un silicate. La réaction produit un dégagement de CO2 qu’on peut retrouver dans les émanations des volcans.
silice
calcite
silicate
Lorsque l’eau se charge de CO2 , l’équilibre chimique se déplace vers la droite: le calcaire est dissout .
Au contraire, lorsque l’eau se vaporise, l’équilibre se déplace vers la gauche: le CO2 est relâché dans l’air et le calcaire se dépose .

vaporisation de l’eau
Si nous écrivons la réaction dans le sens habituel de notre lecture, ça donne:
vaporisation de l’eau
dégagement de CO2
dépôt de calcaire
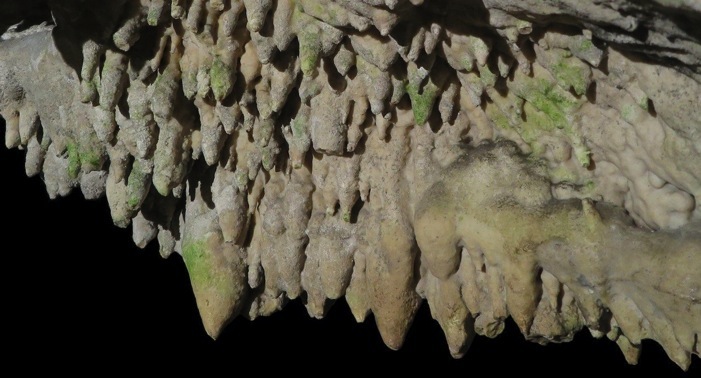
Le dépôt de calcaire prend parfois la forme de belles stalactites et stalagmites dans les grottes.
En résumé:

Cango Caves, Oudtshorn, Afrique du Sud


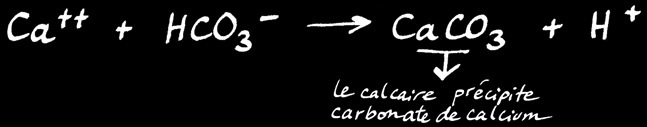
Que se passe-t-il?
La réaction se passe en 2 phases: