Cycles biogéochimiques






Fin de la page
Retour au portail de biologie









Métaux pauvres
Métaux alcalins
Métaux alcalino-terreux
Métaux de transition
Lanthanides
Actinides
Métalloïdes
Non-métaux
Halogènes
Gaz rares






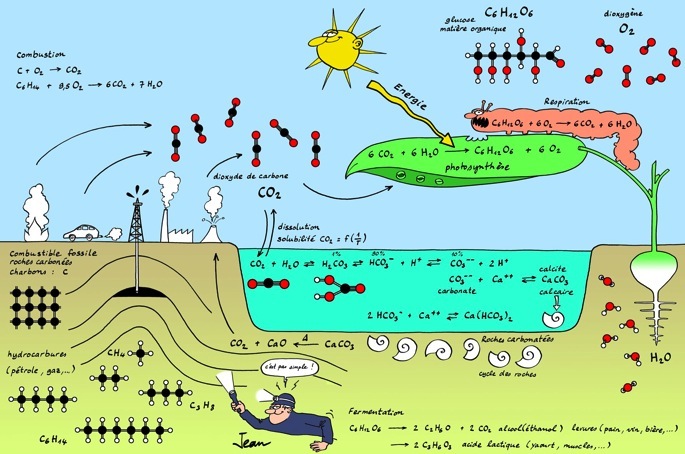
Le cycle du carbone
«Le pétrole», un film de la série «C’est pas sorcier»
«Le bilan carbone», un film de la série «C’est pas sorcier»
«La marée noire», un film de la série «C’est pas sorcier»

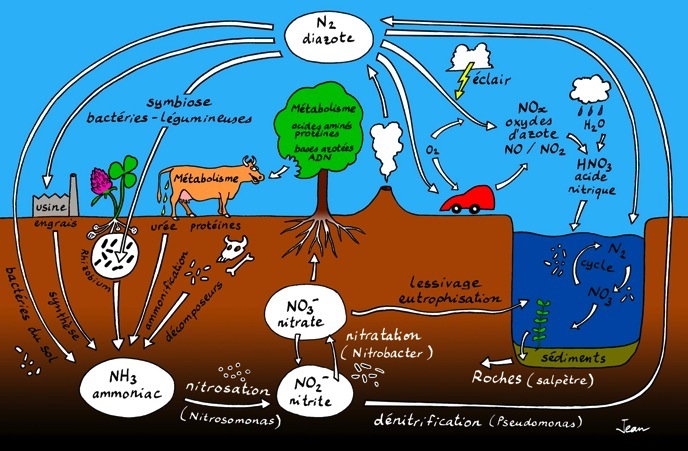
Le cycle de l’azote



Il existe une centaine d'éléments chimiques qui entrent dans la composition de toutes les molécules connues dans notre univers. On peut les classer dans un tableau périodique des éléments selon leurs propriétés.
L'étude des cycles biogéochimiques permet de suivre chaque élément au sein de la biosphère. Ces divers cycles sont liés: on dit qu'ils sont en interaction. L'oxygène, par exemple peut se lier à l'hydrogène pour former de l'eau (cycle de l'eau). Mais aussi avec le carbone pour former des oxydes (cycle du carbone). Le couplage des cycles biogéochimiques permet à la biosphère de trouver un équilibre, de s'auto-réguler. On appelle homéostasie cette faculté d'auto-régulation. Celle-ci est à la base de la stabilité des écosystèmes.
Les cycles les plus importants sont :
le cycle de l'hydrogène (H)
le cycle de l'oxygène (O)
le cycle du carbone (C)
le cycle de l'eau (H20)
le cycle de l'azote (N)
le cycle du phosphore (P)
le cycle du soufre (S)
les cycles des métaux: sodium (Na), potassium (K), calcium (Ca), fer (Fe),...
•
•
•
•
•
•
•
•
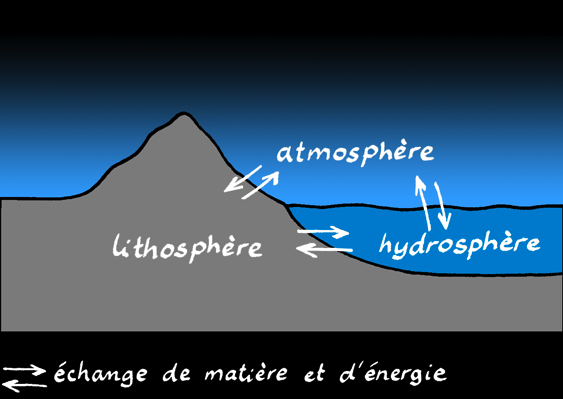
Lors de réactions chimiques, ces éléments peuvent former des assemblages différents. Ils peuvent migrer entre les grands réservoirs que sont la lithosphère (roches), l'atmosphère, l'hydrosphère (l'eau des lac et des océans).
Ils peuvent aussi passer du monde minéral dans le monde organique (dans les êtres vivants) : on parle de biosphère.

La pluie









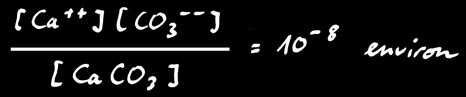

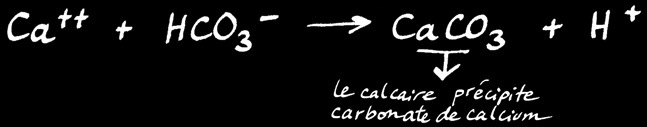
Formation du calcaire
Mais comme le calcaire est très peu soluble, cette réaction n’a pratiquement pas lieu. En effet si on écrit la loi d’action de masse:
Le calcaire se dissous facilement en présence d’acide. Le dioxyde de carbone (gaz carbonique) contenu dans l’air réagit avec l’eau pour former de l’acide carbonique H2CO3.
Celui-ci réagit avec le carbonate insoluble pour former l’ion hydrogénocarbonate (ou bicarbonate) qui est soluble dans l’eau.
bicarbonate de calcium
(soluble dans l’eau)

carbonate de calcium
(presque insoluble)



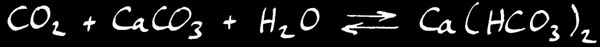


échange avec l’atmosphère
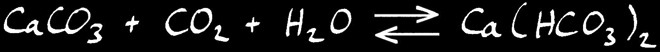
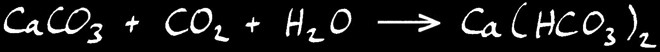
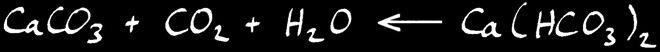



apport de CO2
atmosphérique







Méthane
(gaz naturel)
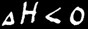


La photosynthèse


Octane
(essence)
Cas général de la combustion des hydrocarbures saturés:

Combustion des hydrocarbures

Combustion des charbons

Respiration cellulaire





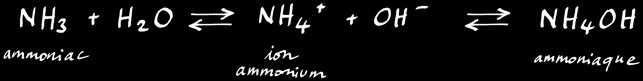



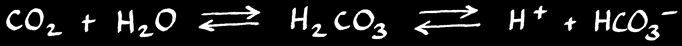

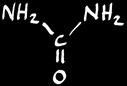


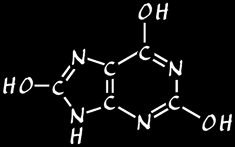
acide urique
urée

Le cycle du phosphore

Le cycle du soufre




Retour au portail de physique

Retour au portail des sciences



Retour au portail de géologie



Retour au portail de chimie






le dégagement de chaleur est noté

carbone
dioxyde de carbone
dioxygène
égageme
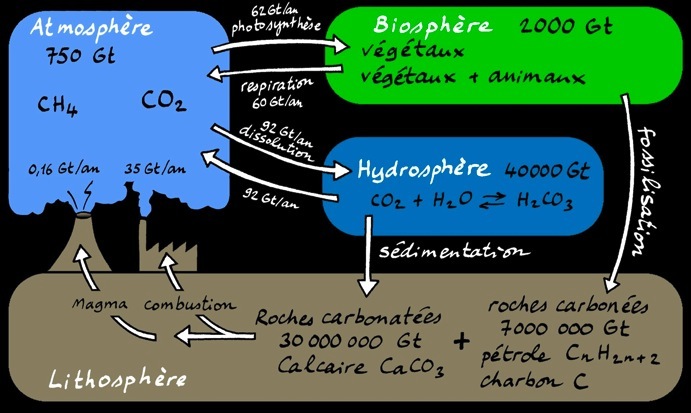
Le carbone entre dans la composition d’une multitude de substances qu’on retrouve sous forme de roches, de gaz, de nourriture, de combustible,... Cette image propose une vision générale et simplifiée du cycle du carbone. On peut l’agrandir en cliquant dessus.
A l’échelle de la planète on peut représenter les différents réservoirs de carbone que constituent l’atmosphère, l’hydrosphère (océans), la lithosphère (roches) et la biosphère (êtres vivants).
Les quantités de carbone sont exprimées en gigatonnes [Gt] autrement dit des milliards de tonnes.
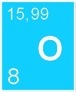
Pour bien comprendre comment le carbone passe d’un réservoir à l’autre, il faut faire un peu de chimie. Les acteurs principaux du cycle du carbone sont 3 atomes: le carbone (symbole chimique: C), l’oxygène (symbole: O) et l’hydrogène (symbole: H).
Dans la nature, ces atomes ne restent pas isolés: ils se lient pour former des molécules selon certaines règles. Le réarrangement de ces molécules a lieu lors de réactions chimiques.
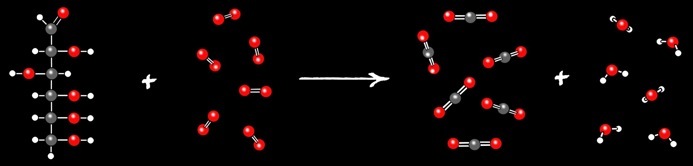
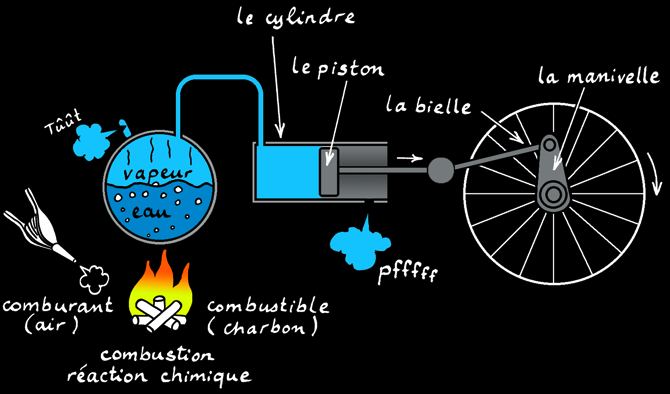
La combustion est une réaction chimique d’oxydation accompagnée d’un grand dégagement de chaleur.
Le charbon n’est idéalement constitué que d’atomes de carbone: la réaction produit donc uniquement de l’oxyde de carbone: dioxyde de carbone.
Les hydrocarbures sont constitués de 2 sortes d’atomes: l’hydrogène (symbole: H) et le carbone (symbole:C). Lors de la combustion (oxydation), il y a la formation de 2 oxydes: CO2 et H2O.
Ces réactions d’oxydation dégagent énormément de chaleur: on dit qu’elles sont exothermiques. Les moteurs thermiques des voitures à essence ou diesel fonctionnent grâce à cette réaction.
Les êtres vivants ont aussi besoin d’énergie chimique. Chaque cellule vivante, qu’elle soit seule (bactérie) ou qu’elle participe a un grand organisme (animal, végétal,...) consomme de l’énergie. L’oxydation de la matière vivante permet de produire de l’énergie qui peut être convertie en chaleur, mouvement (muscle), croissance,...
l’anthracite: un charbon riche en énergie
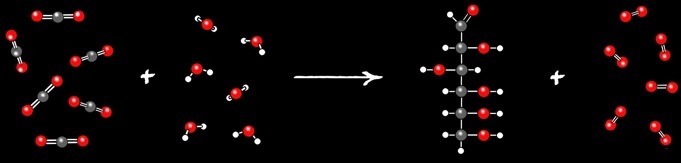
La consommation et l’oxydation du sucre glucose C6H12O6 dans les cellules produit 2 oxydes: CO2 et H2O.
Nous avons vu que les cellules consomment et oxydent du glucose C6H12O6 pour en tirer de l’énergie. La réaction inverse est réalisée dans le monde végétal: les oxydes CO2 et H2O réagissent dans les chloroplastes des plantes pour produire des substances nutritives riches en énergie. L’énergie nécessaire à cette réaction est fournie par le soleil.

Le dioxyde de carbone est gazeux: produit à la surface de la Terre, il se retrouve dans l’atmosphère.
L’utilisation massive du charbon à partir du 19e siècle a permis un essor de l’industrie, des transports ... et de la pollution.
La machine à vapeur est un acteur principal de la révolution industrielle.
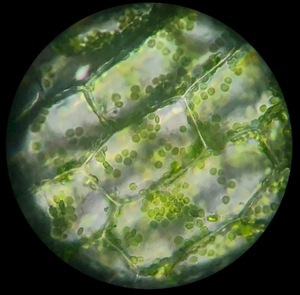

les chloroplastes
(organites vertes)
énergie
solaire
On remarque que la photosynthèse est la réaction exactement inverse de la respiration cellulaire. C’est une réaction fondamentale du monde vivant. On peut noter:
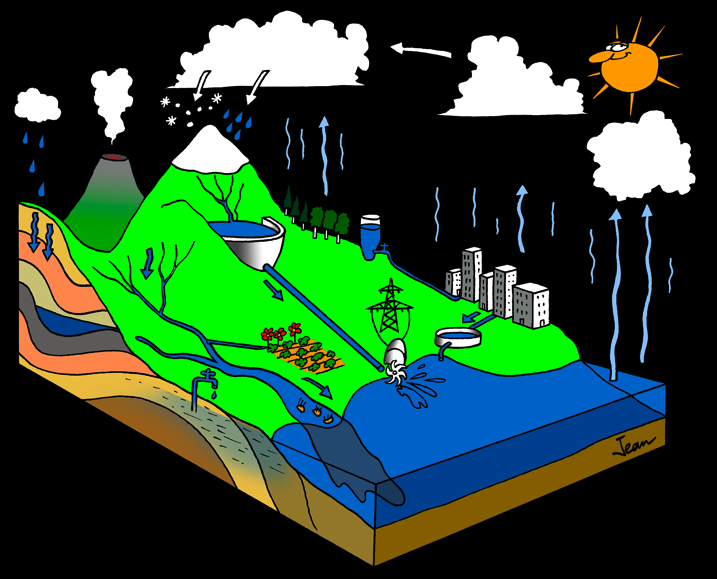
L'eau peut se trouver sous 3 formes différentes (on dit 3 états):


état solide
état liquide
état gazeux



Elle peut changer d’état en fonction de la température et de la pression. Souvent la pression ne joue pas de rôle puisqu'elle varie peu (pression atmosphérique).







augmentation de la température
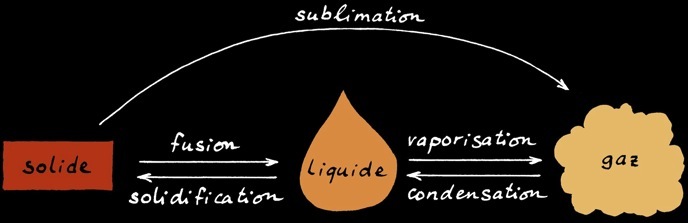
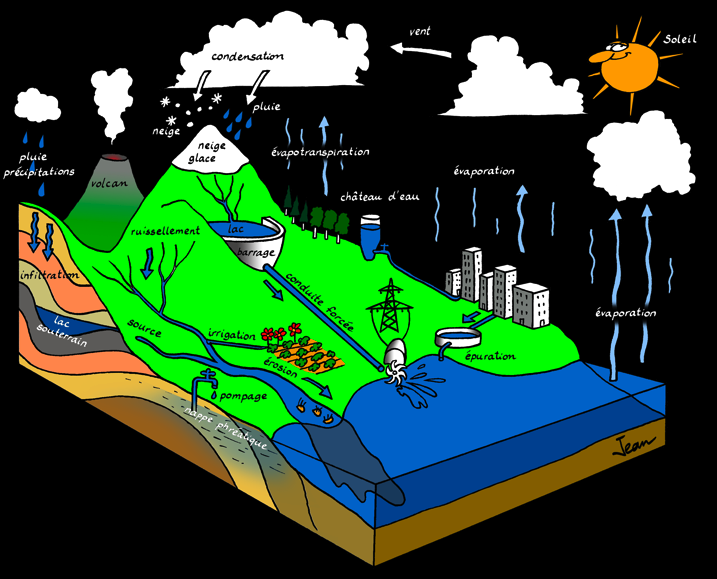
J’ai représenté dans le dessin suivant un paysage. L’eau est partout, à l’état solide, liquide ou gazeux. Comment l’eau circule-t-elle? Comment est-elle mise en mouvement?

Raconte l’histoire d’une goutte d’eau en utilisant les mots qui se trouvent sur le paysage ci-dessous.
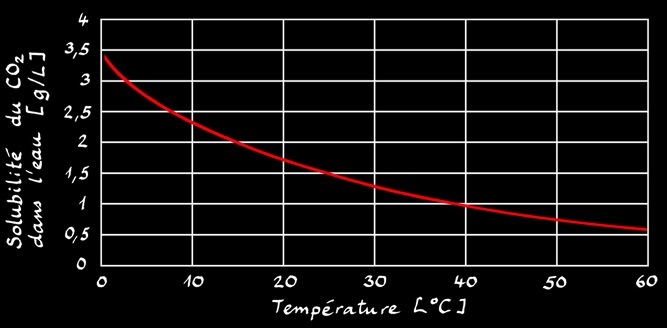
Le dioxyde de carbone CO2 peut se dissoudre dans l’eau liquide. La quantité de gaz dissout est inversement proportionnelle à la température de l’eau: plus l’eau est chaude, moins elle peut contenir de CO2 dissout.
acide carbonique



Une partie du dioxyde de carbone CO2 dissout dans l’eau peut réagir avec elle pour former de l’acide carbonique H2CO3. Celui-ci peut à son tour se dissocier pour former des ions hydrogénocarbonate HCO3- et H+ .
ion
hydrogénocarbonate
Certains animaux aquatiques utilisent l’ion hydrogénocarbonate pour fabriquer leur squelette ou leur coquille calcaire.
calcaire
Lorsque ces animaux meurent, leur coquille calcaire tombe au fond de l’eau. Le calcaire est un sel. En solution aqueuse (dans l’eau), il peut se dissocier et former des ions.
Les coquilles s’entassent donc au fond de l’eau : c’est la sédimentation. Après un long processus (diagenèse), le sédiment se transforme en une roche calcaire solide dans laquelle on peut retrouver des traces d’anciennes coquilles: des fossiles.


L’imposante paroi des Gastlosen dans les Alpes fribourgeoises (Suisse), est formée de sédiments calcaires.
La carrière de marbre, Carrare (Italie)

Altération du calcaire

Dans le cadre d’un réchauffement climatique, peut-on compter sur les océans pour absorber le surplus de dioxyde de carbone CO2 produit dans l’atmosphère?
production de calcaire
dissolution du calcaire

Le ruissellement de l’eau de pluie légèrement acide à la surface des roches calcaires crée des rigoles de dissolution typiques des paysages karstiques. On appelle «lapiaz» ce genre de structures. Ci-dessous le lapiaz du glacier de Tsanfleuron dans le massif des Diablerets (Suisse).


Métamorphisation du calcaire
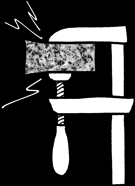

Lorsque le calcaire est soumis à une forte pression et/ou à une élévation importante de température, les cristaux de calcite se réarrangent: le calcaire se transforme (on dit «se métamorphise» en marbre.

échantillon de marbre, Paros (Grèce)
Il arrive aussi que le calcaire réagisse avec la silice SiO2 sous l’effet de la pression et de la température pour former un silicate. La réaction produit un dégagement de CO2 qu’on peut retrouver dans les émanations des volcans.
silice
calcite
silicate

Le cycle du carbone au cinéma
Lorsque l’eau se charge de CO2 , l’équilibre chimique se déplace vers la droite: le calcaire est dissout .
Au contraire, lorsque l’eau se vaporise, l’équilibre se déplace vers la gauche: le CO2 est relâché dans l’air et le calcaire se dépose .

vaporisation de l’eau
Si nous écrivons la réaction dans le sens habituel de notre lecture, ça donne:
vaporisation de l’eau
dégagement de CO2
dépôt de calcaire
Le dépôt de calcaire prend parfois la forme de belles stalactites et stalagmites dans les grottes.
En résumé:

Cango Caves, Oudtshorn, Afrique du Sud
azote atmosphérique
On trouve l’azote (symbole chimique: N) en grande quantité dans l’atmosphère sous la forme d’une molécule diatomique (formée de 2 atomes d'azote) qu’on appelle diazote. Sa formule chimique est N2.
Le diazote est un gaz incolore et inodore. Il forme 78 % du volume (ou 75,5 % de la masse) de l’air .
L’atmosphère contient aussi des oxydes d'azote « NOx », des molécules de gaz formés d’atomes d’azote (N) et d’oxygène (O). Le monoxyde d’azote (NO) et le dioxyde d’azote (NO2) sont très réactifs et toxiques. Ils se forment par oxydation du diazote à haute température dans les moteurs thermiques, les feux et les éclairs. C’est l’une des sources principale de pollution. Le dioxyde d’azote (NO2) réagit avec l’humidité de l’air pour former de l’acide nitrique (HNO3) qui retombe sur Terre sous forme de pluies acides.

Solubilité du CO2

Formation du calcaire