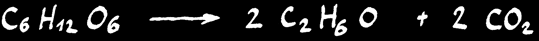La distillation du vin

20°C
88°C.
89°C
90°C
91°C
92°C
95°C
95°C
Substances
Eau
Alcool
Glycérine
Acide lactique
Acide malique
Acide tartrique
Protides
Sels minéraux
Tanins
Quantités [ g/L ]
750 à 900
45 à 160
4 à 20
1 à 12
0 à 10
2 à 5
0.5 à 4
1 à 3
0.1 à 3
Le vin est un mélange homogène complexe dont la composition varie:
D'autres substances (plus de trois cents) participent, même en quantité négligeable, aux qualités organoleptiques du vin: la robe (couleur), le bouquet (odeur), le corps ou la charpente (saveur).
Contrairement aux autres constituants principaux du vin, l'eau et l'alcool sont volatils. On peut donc les soustraire du mélange par une technique de séparation appelée distillation: on chauffe le mélange jusqu'à l'ébullition. La vaporisation puis la condensation des substances volatiles forment le distillat. Celui-ci est un mélange homogène incolore dont la concentration en alcool est supérieure à celle du vin.
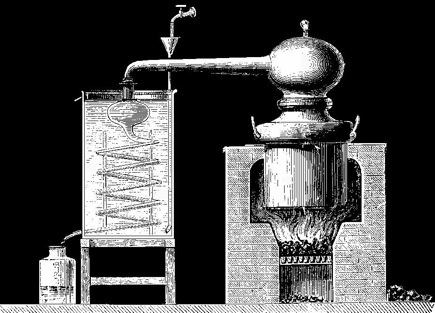
Le premier appareil de distillation connu fut inventé par les Egyptiens il y a près de 2000 ans. Un fourneau supportait un récipient allongé en terre cuite, la cucurbite ("courge"), qui contenait le mélange à distiller. Le col de la cucurbite était surmonté d'un capuchon, l'ambix, où se condensaient les vapeurs. Le distillat s'écoulait vers une fiole. Au milieu du VIIe siècle, l'Egypte fut envahie par les Arabes: l'ambix devient al-anbiq. Ce terme désigne petit à petit tout l'appareil de distillation. Le principe est amélioré par les alchimistes du Moyen-Age: le refroidissement à air est remplacé par un serpentin refroidi à l'eau.
Le terme d'alcool vient de l'arabe al koh'l, qui désignait une poudre très fine à base de stibine (sulfure d'antimoine Sb2S3) qui servait de maquillage pour les yeux. A ce mot s'attache l'idée de finesse et de subtilité que les alchimistes appliquaient aussi bien aux poudres très fines qu'aux principes volatils isolés par distillation. Paracelse nommait "alcool vini" celui qu'on obtenait par distillation du vin (3). Aujourd'hui le terme d'alcool s'applique à la famille de substances organiques qui possèdent le groupe fonctionnel hydroxyle OH.
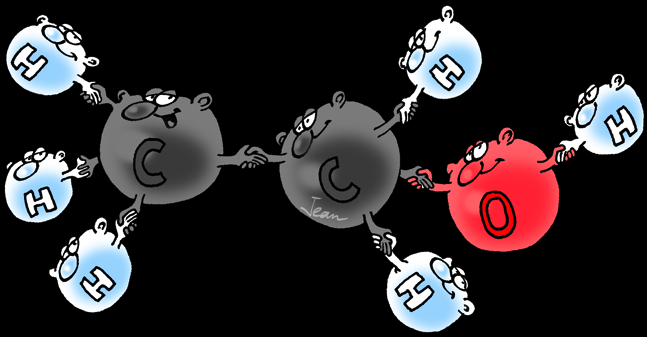
L'alcool éthylique ou éthanol n'est que l'un de ceux-ci: il répond à la formule brute C2H6O ou CH3-CH2-OH
1 ballon de verre 500 ml
1 thermomètre
1 bouchon avec 2 trous
1 bec brûleur
1 tube de verre coudé
1 trépied avec treillis
1 serpentin
2 tubes de caoutchouc
1 pipette
1 becher 100 ml
1.
2.
3.
4.
5.
6.
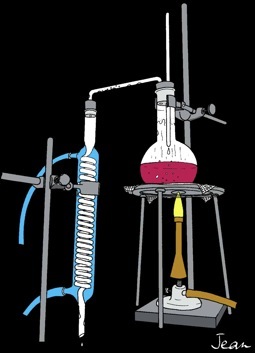
Séparer l'éthanol (alcool éthylique) des autres constituants du vin par distillation.
Noter la température d'ébullition du mélange en cours de distillation.
100
90
80
70
0 10 20 30 40 50 60 70 80 90 100
% alcool poids
Température
[°C]
100
90
80
70
0 10 20 30 40 50 60 70 80 90 100
% alcool poids
Température
[°C]

Temps [mn]
0
8
10
13
15
17
26
28
Nous avons recueilli 60 ml d’un mélange incolore eau / alcool. Il reste 140 ml d'un résidu de vin chaud faiblement alcoolisé et acide.
Allumage
Début de l'ébullition
Le distillat (incolore) commence à couler
Goût prononcé d’alcool
-
-
-
Faible goût d'alcool
1.
2.
3.
4.
Le distillat est incolore. C’est un mélange contenant les substances les plus volatiles du vin. Les colorants restent dans le ballon.
La température d’ébullition du mélange n’est pas constante. Elle varie continuellement de 88°C à 95°C. A mesure que le vin est débarrassé de son alcool, la température d’ébullition du mélange se rapproche de celle de l’eau.
Le vin contient environ 10% de son poids en alcool (soit 12% de son volume, en effet la densité de l’alcool est plus faible que celle de l’eau soit d=0,8)
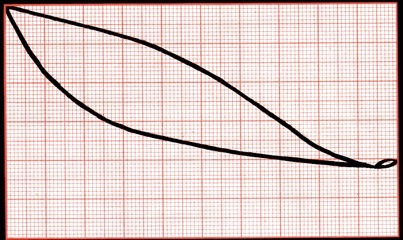
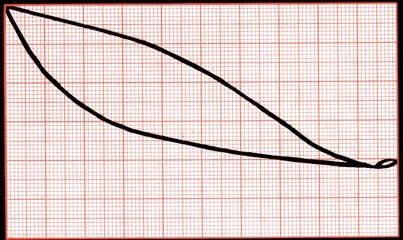
Les premières gouttes de distillat sont riches en alcool. Le graphique ci-dessous permet de comprendre. Suivons les flèches grises: prenons en bas un mélange contenant 10% d’alcool et montons à la verticale (le mélange se réchauffe). Nous arrivons sur une courbe noire à la température de 93°C. Cette courbe (celle du bas), décrit la température d’ébullition du mélange alcoolique en fonction de sa teneur en alcool. Nous partons ensuite à l’horizontale jusqu’à la seconde courbe (celle du haut) qui représente la teneur en alcool des vapeurs du distillat. Il ne reste qu’à descendre afin de connaître le % d’alcool des premières gouttes: 50%
5.
En fin d’expérience, après 26 minutes la température d’ébullition est de 95°C. On peut déduire du graphique ci-dessous que le vin ne contient plus que 5% d’alcool, alors que les vapeurs qui se condensent à ce moment-là en contiennent encore 35%.


6.
Si nous dégustons le vin chaud en fin d’expérience, on ne sent plus l’alcool. Par contre son goût est terriblement acide. Ces acides n’ont pas été produits au cours de l’ébullition: ils étaient déjà là avant. Ils étaient seulement masqués par le goût prononcé de l’alcool: celui-ci s’étant évaporé, le goût acide peut ressortir. En fait le jus de raisin (avant la fermentation) est aussi acide mais cette acidité est aussi masquée par le sucre (qui sera transformé par les levures en alcool). Le même phénomène se rencontre avec le Coca, lui aussi à la fois très acide et très sucré.
1.
2.
3.
4.
J-P. et C. Navarre. Manuel d’oenologie. Editions Baillière. 1986
-
A.Lichine. Encyclopédie des vins & des alcools. Bouquins, Robert Laffont, 1986.
B. Rowley et J.-C. Ribaut. Le vin, une histoire de goût. Découvertes Gallimard, 2003
Encyclopédie Wikipedia: http://fr.wikipedia.org/wiki/Distillation
Video de la distillation (durée 1’50’’)

1.
2.
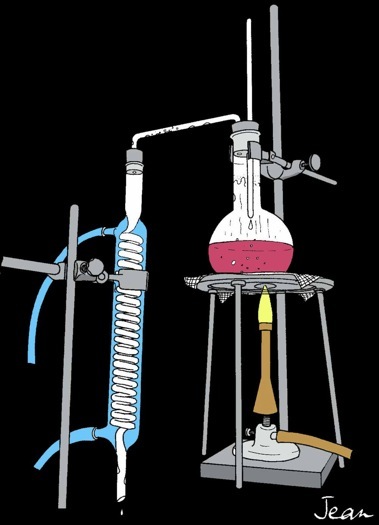
Réaliser le montage du matériel d'après le dessin.
Mettre 200 ml de vin rouge de titre connu (12°alc.)
dans un ballon de 500 ml.
Faire circuler l'eau froide dans le circuit
de réfrigération du serpentin.
Chauffer jusqu'à l'ébullition et attendre
l'arrivée du distillat (env. 10 minutes).
Noter la température du liquide qui reflue
goutte à goutte sur le thermomètre.
Cesser de chauffer lorsque le distillat
n'a plus un goût prononcé d'alcool.


Buts de l'expérience
Matériel

Introduction

Méthode

Résultats

Remarques

Conclusions

Références
Retour au portail des sciences



Retour au portail de chimie







Résumé du cours





Un alambic, XIXe siècle
Remarques
Température [°C]


Fin de la page
Les levures et la fermentation
Les levures, champignons unicellulaires et microscopiques, sont des organismes eucaryotes. Celles du genre Saccharomyces sont utilisées par l'homme pour la fabrication du pain, de la bière et du vin. Elles sont les agents de la réaction de fermentation alcoolique. Lors de cette réaction, le glucose est transformé dans des conditions anaérobies selon l'équation:
C6H12O6--->2 C2H6O + 2 CO2