Les gaz parfaits


Retour au portail des sciences



Retour au portail de chimie






Loi des gaz parfaits









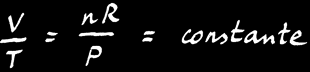
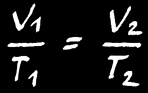


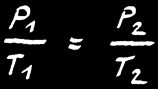

La loi des gaz parfaits est une relation simple qui lie le volume (V), la pression (P) et la température (T) d’un gaz:
La loi des gaz parfaits n’est rigoureusement juste qu’à certaines conditions:
le système doit être isolé: s’il y a un transfert de matière, le nombre de mole «n» n’est plus constant.
Le «volume propre» des molécules doit être négligeable par rapport au volume occupé par le gaz. La loi n’est plus valable à très haute pression.
Les molécules ne doivent pas interagir les unes avec les autres autrement que par des chocs aléatoires.
•
•
•
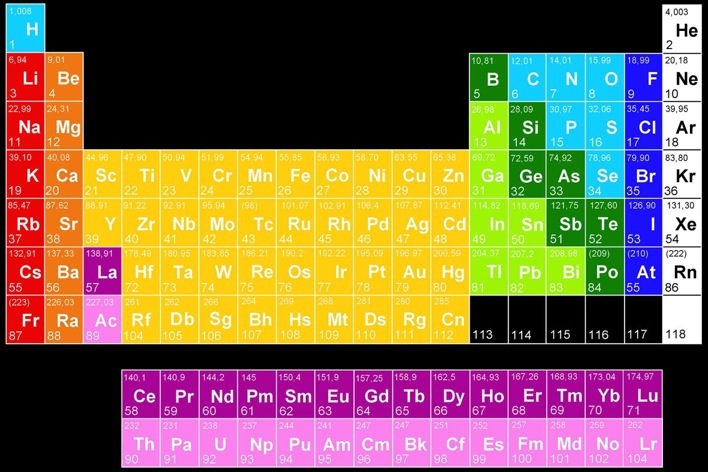
Ces conditions sont réalisées chez les gaz rares: Ils sont monoatomiques et leurs atomes n’ont aucune affinité les uns pour les autres. On les trouve dans la 8e colonne du tableau périodique.
Pour tous les autres gaz, on se contentera d’une bonne approximation.
Gaz rares

Si la réaction se fait à température constante , alors:

Si la réaction se fait à pression constante , alors:




Si la réaction se fait à volume constant , alors:


Fin de la page
avec:
P : pression
V : volume
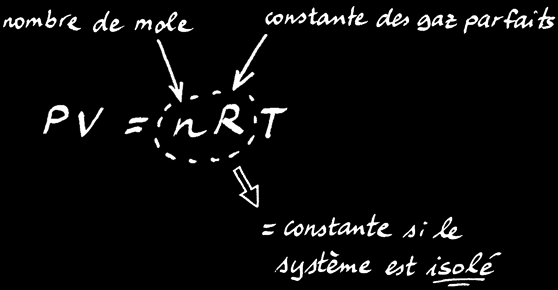
n : nombre de moles de gaz
R : constante des gaz parfaits
T : température
Valeurs de R dans le système d'unités 1 :
1 [atm] . 22,4 [L] / 1 [mol] . 273 [K] = 0,082 [ atm . L . mol-1 . K-1 ]
Valeurs de R dans le système d'unités 2 :
101300 [N/m2] . 0,0224 [m3] / 1 [mol] . 273 [K] = 8,31 [ J .mol-1. K-1 ]
système 1
To = 273,15 [K]
Po = 1 atmosphère [atm]
Vo = 22,4 [L]
système 2
To = 273,15 [K]
101300 pascals [Pa] ou [N/m2]
Vo = 0,0224 [m3]
Température normale :
Pression normale :
Volume molaire
Lorsque nous travaillons dans d'autres conditions, nous utiliserons la loi des gaz parfaits dont il faut se souvenir de la formule magique :
PV = nRT


Conditions normales P et T


Les réactions chimiques sont très sensibles aux conditions de température (T) et de pression (P).
En effet elles vont déterminer les vitesses de réactions, les déplacement d’équilibres, voire l’existence même de certaines réactions.
Nous pouvons définir des conditions "normales" qui règnent sur Terre et dans les laboratoires:
On peut travailler dans 2 systèmes d'unités différents:
la pression d’une atmosphère (ou 101300 pascals [Pa]
la température de 0°C , de 20°C ou de 25°C suivant les cas.
•
•

Simplifications
Les réactions chimiques peuvent se faire à température constante ou à pression constante . Il est possible alors de simplifier les problèmes:


La réalité est souvent très compliquée. Et lorsqu’on veut décrire la nature, on est souvent obligé de se faire une représentation plus simple: un modèle. C’est à ce prix qu’on peut comprendre certains phénomènes naturels. Notre modèle est une sorte de caricature qui permet de saisir l’essentiel d’un phénomène en laissant volontairement quelques détails de côté. Le modèle décrit bien la réalité mais il n’est valable que dans certaines limites. Il faut donc toujours se rappeler que:
un modèle n’est pas la réalité, mais une représentation de celle-ci.
un modèle n’est valable que dans certaines limites qu’il faut connaître.
Lorsqu’on s’approche des limites du modèle, nos jugements sont déformés, voire complètement faux. Il faut penser à changer de modèle... et ça se complique!
•
•
•

Le modèle du gaz parfait
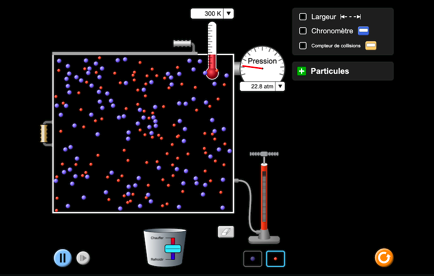
Un gaz est un ensemble de corps physiques (atomes, molécules) en constante agitation. Ces corps ont une masse et sont parfois porteurs de charges électriques. Dans leur existence agitée, ils peuvent s’entrechoquer, s’influencer mutuellement avec des forces électriques, magnétiques,... réagir entre eux pour former de nouveaux corps. En bref, c’est très compliqué.
Et pourtant, en 1811, le physicien italien Amadeo Avogadro s’est rendu compte que si on prend une certaine quantité de n’importe quel gaz à la température ambiante et à la pression atmosphérique , il occupe à peu près un volume de 22,4 litres.
Le volume, la pression et la température d’un gaz sont 3 grandeurs liées entre-elles chez les gaz. Si on connaît le volume et la température d’une certaine quantité de gaz, on peut en déduire la pression qui règne dans le système.
Des relations mathématiques simples décrivent bien la réalité des gaz si on fait quelques simplifications. On invente alors un gaz idéal, un gaz “parfait” qui aurait quelques propriétés:
le système doit être isolé: s’il y a un transfert de matière, on ne peut plus rien dire.
Le «volume propre» des “particules de gaz” doit être négligeable par rapport au volume occupé par le gaz. Le gaz parfait est donc formé de particules minuscules entourées de beaucoup de vide. La “loi des gaz parfaits” n’est plus valable à très haute pression.
Les “particules de gaz” ne doivent pas interagir les unes avec les autres autrement que par des chocs aléatoires.
•
•
•

Simplifier pour comprendre


Animation «gaz»