Hydrocarbures





Fin de la page
Suite du cours: Les alcanes
Retour au portail des sciences

Retour au portail de chimie






•
•
•
les alcanes: des hydrocarbures saturés avec des liaisons simples entre atomes de carbone
les alcènes: des hydrocarbures insaturés avec des liaisons doubles entre atomes de carbone
les alcynes: des hydrocarbures insaturés avec des liaisons triples entre atomes de carbone
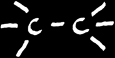


Dans le cadre de la chimie, on peut classer les hydrocarbures en 3 catégories selon le type de liaison entre atomes de carbone:
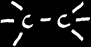







Définition
Leur importance économique est colossale puisqu’ils constituent les gisements de pétrole, de gaz naturel, de gaz de schiste,...
L’exploitation et l’utilisation des hydrocarbures fossiles est à l’origine de l’essor industriel du 20e siècle et du développement de l’automobile à essence et des transports.
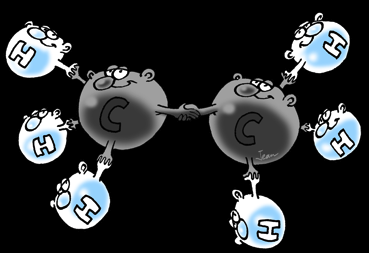
Les hydrocarbures sont des substances chimiques organiques formées uniquement d’atomes de carbone (C) et d’hydrogène (H).
Les hydrocarbures sont hydrophobes: ils «n’aiment pas l’eau».
Clique sur la molécule d’alcane.


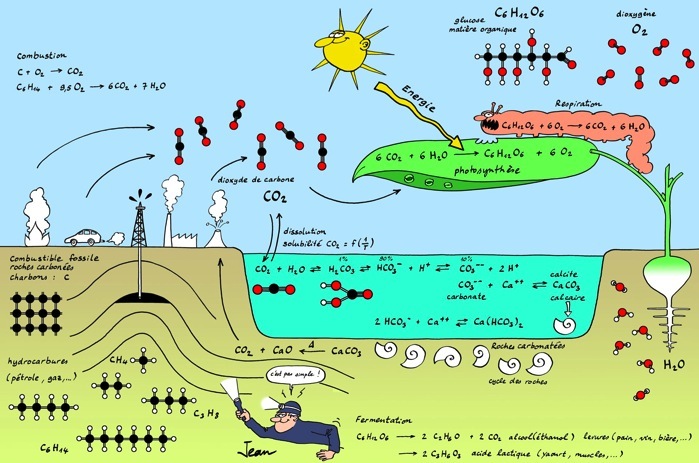
Le cycle du carbone


Le pétrole en Suisse

Echantillon de pétrole provenant du forage d’Essertines (canton de Vaud) daté 8 avril 1963

Un hydrocarbure est une molécule formée d’atomes de carbone (symbole:C) et d’hydrogène (symbole: H). Certains hydrocarbures forment des chaînes simples de différentes longueurs.
Une molécule d’hydrocarbure est assez instable. Elle a tendance à réagir avec l’oxygène (réaction d’oxydation) en brûlant et en dégageant beaucoup de chaleur. On parle de réaction de combustion.
Etudions une réaction de combustion: celle du pentane (avec 5 atomes de carbone).
Avant = système initial
les réactifs
Après = système final
les produits
sens de la réaction
On peut aussi représenter cette réaction de manière plus claire en regroupant les molécules semblables:
Ou avec des symboles chimiques:

Combustion des hydrocarbures
D’autres des chaînes ramifiées. D’autres encore se referment sur eux-mêmes et forment des cycles. Tout est possible pour autant de respecter les règles du jeu: le carbone se lie 4 fois tandis que l’hydrogène n’a qu’une liaison.


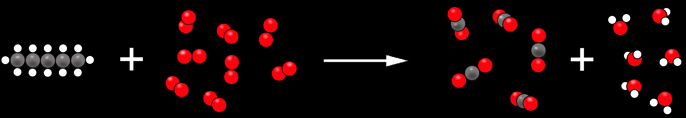
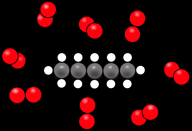
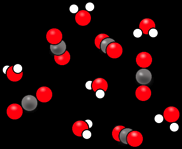
Avant = système initial
les réactifs
Après = système final
les produits





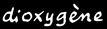




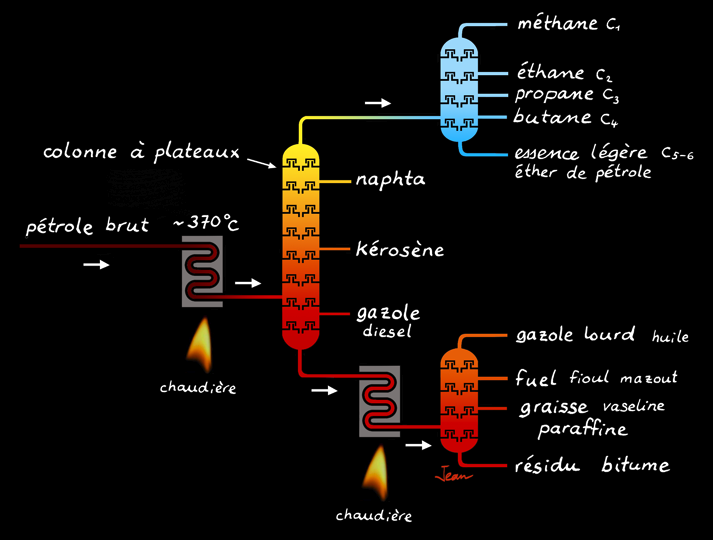
pétrole brut
essence
kérozène
diesel
mazout
distillat
paraffine
soufre
résidu





Cette équation ne dit rien sur:
Les quantités de réactifs et de produits
L’état des réactifs et des produits (solide, liquide, gaz)
La vitesse de réaction (lente, rapide, explosive...)
L’aspect énergétique (absorption ou dégagement de chaleur)
Les conditions de pression et de température qui influencent la réaction
le mécanisme réactionnel (compréhension “au ralenti” des phases de la réaction)
1.
2.
3.
4.
5.
6.
L’équation chimique n’est qu’un bilan de la réaction. Elle donne des renseignements sur l’état initial (réactifs) et sur l’état final (produits) du système, mais en aucun cas sur l’évolution de celui-ci durant la réaction.



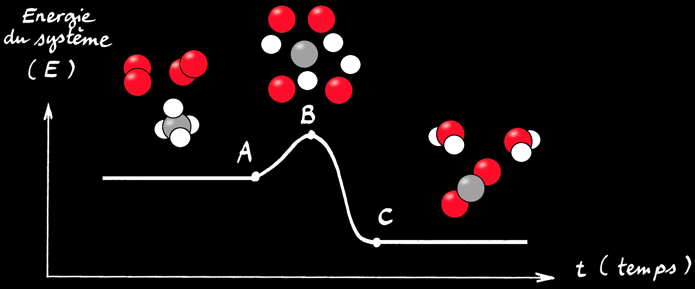
L’énergie d’activation
pentane
état transitoire

La réaction est globalement exothermique: elle dégage de l’énergie. Mais pour l’initier il faut d’abord lui donner un petit «coup de pouce» sous forme d’énergie (chaleur, étincelle, choc): c’est l’énergie d’activation. On peut ainsi imaginer une représentation simpliste d’un état transitoire où tous les atomes sont séparés.
La réaction de combustion du méthane s’écrit: