Masse et lois pondérales

Quel est l'intérêt d'utiliser ce nombre?
Nos balances ne nous permettent pas de mesurer la masse d’un seul atome ou d’une seule molécule. Lorsque nous faisons des expériences nous utilisons des milliards de milliards d’atomes. Une simple goutte d’eau (environ 0,05 ml) compte déjà environ 16723100000000000000 molécules !
Il est indispensable de travailler sur une immense collection d’atomes et de molécules. Lorsqu’on prend une collection d’atomes correspondant au nombre d’Avogadro, on a une quantité de matière qu’on appelle une mole. Et cette notion de mole nous sera très utile.



Suite du cours: les gaz parfaits
Retour au portail des sciences



Retour au portail de chimie








Un atome d'hydrogène a une masse de 1 u.m.a.
Une mole d'atomes d'hydrogène a une masse de 1 gramme
1 molécule de NaOH a une masse de 40 u.m.a.
Une mole de NaOH a une masse de 40 grammes
La mole est donc une unité très pratique en chimie et en physique. Elle permet de décrire des objets aussi petits que des atomes et des molécules avec des unités de la "vie quotidienne". L'unité de la mole s'écrit [mol].

Notions fondamentales
L'usage systématique de la balance a permis au chimiste Lavoisier de proposer sa loi de la conservation de la masse qu'on énonce souvent «rien ne se crée, rien ne se perd, tout se transforme»

La masse atomique

La masse moléculaire
Les chimistes ont toujours besoin d'exprimer les masses des différents éléments les uns par rapport aux autres.
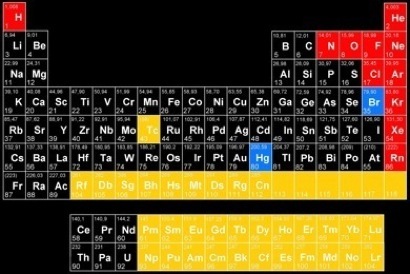
La masse atomique que l'on trouve dans le tableau périodique des éléments est la masse moyenne des éléments: c'est la moyenne des masses des divers isotopes d'un élément.
Atome-gramme at.-g
C'est la quantité d'un élément exprimé en grammes par le même nombre que la masse atomique.
Exemples:
1 at.-g d'hydrogène = 1 g d'hydrogène
1 at.-g de carbone = 12 g de carbone
1 at.-g de fer = 56 g de fer
3 at.-g de soufre = 3 (S)g de soufre
= 3 . 32g de soufre
= 96 g de soufre
Molécule-gramme mol.-g
C'est la quantité d'une substance exprimée en grammes par le même nombre que la masse moléculaire.
Exemple: 1 mol.-g de H2SO4 = (2.1) + 32 + (4.16) = 98 [g]
Exercice: Combien de moles représentent 1 gramme de CaCO3 ?
Masse moléculaire du :
C'est la somme des masses atomiques qui constituent un corps.
Une collection de 1000 objets s'écrit mille. On peut aussi écrire 103
Une collection de 1’000’000 objets s'écrit million. On peut aussi écrire 106
Une collection de 1’000’000’000 objets s'écrit milliard. On peut aussi écrire 109
En chimie, il a fallu inventer un nouveau nombre pour compter les gigantesques collections d'atomes et de molécules: ce nombre est appelé nombre d'Avogadro. C'est une collection de 602200000000000000000000 objets.
On le note

Le nombre d’Avogadro
NA

La mole
[ mol ]
Aux conditions normales de température et de pression (TPN), une mole de gaz occupe un volume constant :

Le volume d’Avogadro
VA
Problèmes types de stoechiométrie
1. Teneur d'un corps
Quelle quantité de bore peut-on extraire à partir d'une tonne de borax Na2B4O7 . (H2O)10 si le rendement de l'opération est de 80% ?
Réponse : 92 [Kg]
2. Masse d'un corps
Combien faut-il prendre de grammes d'aluminium pour obtenir 1 tonne de chlorure d'aluminium selon la réaction : Al + Cl2 ---> AlCl3 (équilibrer l'équation)
Réponse : 2,02.105 [g] ou 202 [Kg]
3. Volume d'un corps participant à une réaction à TPN
Quel volume d'oxygène (gaz dioxygène) faut-il aux conditions normales de température et de pression pour transformer 100 [g] de fer en magnétite Fe3O4 ?
Réponse : 26,7 [L] ou 0,0267 [m3]
4. Volume d'un corps participant à une réaction si les conditions ne sont pas normales
Quel volume d'oxygène (gaz dioxygène) faut-il à 100 [°C] et 2 [atm] de pression pour brûler 270 [g] d'aluminium ?
Réponse : 114,7 [L] ou 0,114 [m3]
5. Composition centésimale d'un corps ( teneur en % )
Quelle est la composition centésimale du K2Cr2O7 ?
Réponse : 26,5 % de K _ 35,4 % de Cr _ 38,1 % de O
6. Formule d'un corps
Retrouver la formule d'un corps, connaissant sa composition centésimale ( donnée par l'analyse ) . Un acide organique a une masse moléculaire de 60 [g/mol]. Sa composition est 40 % de C _ 6,7 % de H _ 53,3 % de O . Quelle est sa formule ?


Fin de la page
« … rien ne se crée, ni dans les opérations de l'art, ni dans celles de la nature, ..., il y a une égale quantité de matière avant et après l'opération ; que la qualité et la quantité des principes est la même, et qu'il n'y a que des changements, des modifications».
Lavoisier, Traité élémentaire de chimie (1789)
La quantité de matière (masse) consommée dans une réaction chimique est égale à la quantité de matière produite au cours de la réaction.
Le symbole de l'élément entre parenthèses prends la valeur d'un chiffre, qui sera toujours arrondi à l'unité (pour simplifier les calculs), sauf :
(Cl) = 35,5 u.m.a et (Cu) = 63,5 u.m.a
(H) = 1,008 u.m.a
(C) 12,01 u.m.a
(Fe) = 55,847 u.m.a
(Cl) 35,453 u.m.a
Notation:
= (Na) + (O) + (H)
= 23 u.m.a + 16 u.m.a + 1 u.m.a
= 40 u.m.a
= 2(H) + (S) + 4(O)
= 2 (1 u.m.a) + 32 u.m.a + 4. (16 u.m.a)
= 2 u.m.a + 32 u.m.a + 64 u.m.a
= 98 u.m.a
(NaOH)
Exemples:
(H2SO4)
1 atome de Fe ?
1 mole de Fe ?
1 atome de H ?
1 molécule de H2 ?
1 mole de H2 ?
1 mole de HNO3 ?
1 mole de NaCl ?
1 mole de CaCl2 ?
1 mole de N2 ?
Quelle est la masse de:


Quelle est la masse atomique :
a) du fer
b) du sodium
c) du chrome
d) du soufre
e) de l'or
f) de l'azote
g) du cuivre
h) de l'argon
i) du chlore

Quelle est la masse moléculaire de:
a) K2Cr2O7
b) H3PO4
c) NaH2PO4
d) diazote
e) "oxygène"
f) Al2O3
g) Fe3O4
h) Fe2O3
i) NH3
j) H2O

a) 32 g de dioxygène ?
b) 2 mol de H3PO4 ?
c) 10 g de CaCO3 ?
d) 22,4 L de néon ?
e) 22,4 litres d'ozone ?
f) Al2O3 ?
g) 49 grammes de H2SO4 ?
h) 1 mole d'eau ?
i) 1 mol de H2O ?
j) 1 mole d'hélium ?
Combien y a-t-il d’atomes dans:

Une mole d'atomes, c'est la quantité d'un élément exprimé en grammes par le même nombre que sa masse atomique.
Une mole de molécules, c'est la quantité de cette molécule exprimé en grammes par le même nombre que sa masse moléculaire.
1 mole d'atomes d'hydrogène
1 mole d'atomes de carbone
1 mole de molécules de NaOH
1 mole de molécules de H2SO4
= 6,02.1023 atomes d'hydrogène
= 1 gramme d'hydrogène
la masse est une grandeur physique. Elle représente la quantité de matière d'un corps. Elle n'est jamais négative. On mesure la masse d'un corps lors d'une pesée avec une balance. Il suffit de poser la masse à mesurer sur le plateau d'une balance et de la comparer avec une masse étalon de grandeur connue.

La masse
•
•
la masse d'un corps représente la quantité de matière de ce corps. Elle s'exprime en kilogramme [kg]
le poids d'un corps représente la force d'attraction (gravitation) exercée par la planète Terre sur ce corps. Elle s'exprime en Newton [N]. Une relation simple relie la masse et le poids:

Il faut se rappeler que l’essentiel de la masse d’un atome (99,9%) est concentrée dans son noyau. C’est là que se trouvent les particules les plus “massiques”: les nucléons (protons et neutrons).
noyau

Dans l’écriture courante, on symbolise l’hydrogène
La valeur de la masse atomique est arrondie à 1. En effet la valeur de la masse atomique (1,008) est une moyenne de la masse d’une population d’atomes: les différents isotopes.



Masse atomique
= nombre de nucléons
(protons + neutrons)
numéro atomique
= nombre de protons dans le noyau
= nombre d’électrons dans l’enveloppe électronique
symbole de l’élément
“H” pour hydrogène






Prenons un atome d’hydrogène: c’est le premier du tableau périodique des éléments.




solide
liquide
gaz
artificiel
Exemples:
masse atomique de l'hydrogène : 1,008 unités de masse atomique ( = u.m.a )
masse atomique du carbone : 12,01 u.m.a
masse atomique du fer : 55,847 u.m.a
masse atomique du chlore : 35,453 u.m.a
Exemple:
Quel est le volume occupé aux conditions normales par 14 [g] du gaz diazote N2 ?
Le diazote est un gaz diatomique. Il est formé de 2 atomes d'azote.
1 mole d'atomes de N a une masse de 14 [g]
1 mole de molécules de N2 a une masse de 28 [g]
Donc 14 grammes représentent la masse de 0,5 mole de ce gaz N2
Le volume d'une mole de gaz quelconque est de 22,4 [L]
Donc 0,5 [mol] occupe la moitié de ce volume, soit 11,2 [L]
On a tendance a confondre la masse avec le poids alors que ce sont 2 grandeurs différentes:
«La mole est la quantité de matière d’un système qui contient autant d’entités élémentaires qu’il y a d’atomes dans 12 grammes de carbone 12»
Définition:
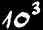


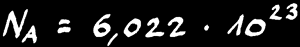



Les conditions "normales" de température et de pression sont:
La pression normale
1 atmosphère [atm] = 760 mm de mercure [mm Hg] = 1,013 25 . 105 pascals [Pa]
La température normale
0 degrés celsius [°C] = 273,15 kelvin [K]

Il est nommé en l'honneur du physicien et chimiste italien Amedeo Avogadro (1776 - 1856).

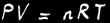

= 6,02.1023 molécules de H2SO4
= 98 grammes de NaOH

= 6,02.1023 molécules de NaOH
= 40 grammes de NaOH
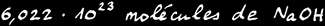
= 6,02.1023 atomes de carbone
= 12 grammes de carbone
