Modèles atomiques




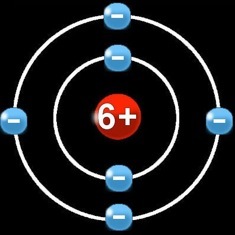
Le carbone a 2 électrons sur la 1e couche qui ne peut contenir que 2 électrons au maximum:
et 4 électrons sur la 2e couche qui pourrait en abriter 8 en tout:



Représentation de l’atome
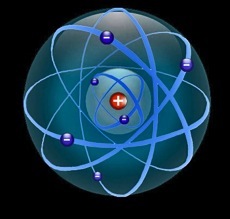
L’atome est si petit qu’il est impossible de le voir. Par contre on peut se le représenter:
il suffit d’un peu d’imagination.
Notre représentation de l’atome a beaucoup changé depuis son apparition dans la philosophie en Grèce. Comme toute représentation, elle évolue en fonction de nos connaissances.
Vers 1850, on se représente l’atome comme une sphère électriquement neutre.
Par exemple le carbone.
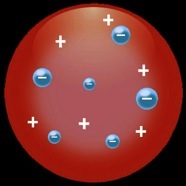
En 1897, on découvre que l’électricité n’est pas un fluide (continu) mais un ensemble de particules (discontinues) qui portent une charge négative: on les nomme «électrons». On représente alors l’atome comme une sorte de pain aux raisins: une pâte positive qui renferme des grains négatifs (les électrons).
Ici on voit le carbone avec ses 6 électrons.
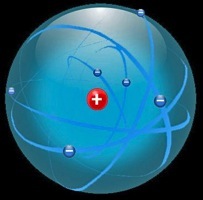
En 1911, en bombardant une feuille d’or avec un puissant rayonnement alpha, Ernest Rutherford a la surprise de constater que l’atome est surtout constitué de vide et que les charges positives sont toutes concentrées dans un noyau central. Ici les 6 électrons du carbone occupent l’espace sphérique autour du noyau.
1.
2.



1913 Modèle de Bohr

En 1913, Nils Bohr propose une nouvelle image de l’atome qui s’accorde mieux avec les expériences. Il reprend l’image du modèle planétaire d'Ernest Rutherford qui décrit l'atome comme un noyau chargé positivement, autour duquel se déplacent les électrons chargés négativement.
Il émet quelques hypothèses révolutionnaires:
Suite du cours: l’atome



Suite du cours: le tableau périodique

Suite du cours: la liaison chimique



Retour au portail de chimie


Retour au portail des sciences









vers 1850

1897

1911 Ernest Rutherford
Pour des raisons pratiques, nous représentons les atomes à 2 dimensions:
Le carbone (C) a un numéro atomique = 6

Modèle en couches et sous-couches

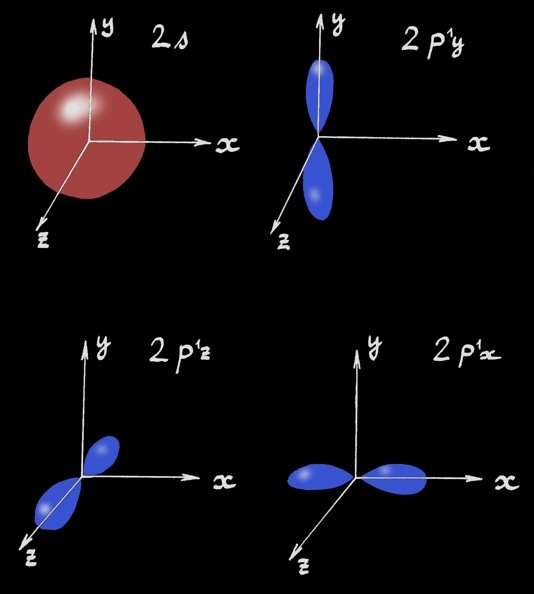
Modèle à orbitales


3
4 ...
2
1
Les électrons ne peuvent pas se trouver n’importe où dans un atome. Ils tournent sur des orbites stationnaires: sur ces orbites privilégiées, les électrons ne perdent pas d’énergie. Ils devraient normalement finir leur course en chutant sur le noyau comme le voudrait la physique classique (comme les satellites autour de la Terre). Mais ce n’est manifestement pas le cas, d’où cette hypothèse.
Les électrons “gravitent” sur des orbites qui correspondent à différents niveaux d’énergie discontinus.
On dit que l’énergie est quantifiée.
Les orbites sont numérotées: n = 1, 2, 3, 4, ...
du centre vers la périphérie de l’atome.
3.
4.
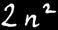
On trouve au maximum électrons par couche.
La première orbite ( 1 ) peut contenir au maximum 2 électrons.
La deuxième orbite ( 2 ) peut contenir au maximum 8 électrons.
La troisième orbite ( 3 ) peut contenir au maximum 18 électrons.
La quatrième orbite ( 4 ) peut contenir au maximum 32 électrons.
Les électrons peuvent passer d’une orbite stable à l’autre en échangeant des “paquets” d’énergie ou “quantum d’énergie” qu’on appelle photons.
Il a donc:
-
•6 protons (+) dans le noyau
-
•2 électrons (-) sur la 1ere orbite
-
•4 électrons (-) sur la 2e orbite
En 1932, l’anglais James Chadwick découvre une nouvelle particule nucléaire (particule dans le noyau de l’atome): le neutron.
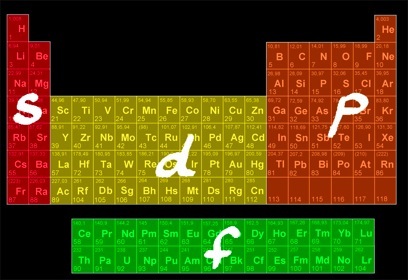
Les sous-couches sont désignées par des lettres minuscules (s, p, d, f) qui viennent de la description (en anglais) des raies du spectre: sharp, principal, diffuse, fundamental.
Nous savons qu'un satellite qui retombe sur Terre restitue l'énergie qu'on lui a fournie pour le mettre sur orbite sous forme de lumière et de chaleur. De même, l'électron que l'on a excité en lui donnant de l'énergie pour le faire passer sur une couche supérieure, émet en retombant de l'énergie électromagnétique (lumière, chaleur,...)
Pour un atome donné, les transitions possibles (les sauts possibles) sont nombreux et font apparaître plusieurs radiations. C'est le principe de l'analyse spectrale qui permet, par la décomposition de la lumière émise, l'analyse en chimie et en astronomie.
L'analyse spectrale a permis de connaître la composition chimique d'étoiles lointaines mais aussi de vérifier les hypothèses de Bohr qui sont correctes mais insuffisantes. Il a fallu introduire de nouveaux nombres quantiques pour arriver à une nouvelle image de l'atome:
Le nombre quantique principal (n) définit le niveau moyen d'énergie: la couche.
Le nombre quantique azimutal (l) décrit l'excentricité (rapport entre le grand et le petit axe) de l'ellipse.
Le nombre quantique magnétique (m) définit l'orientation dans l'espace de la trajectoire de l'ellipse.
Le nombre quantique de spin (s) exprime le fait que l'électron «tourne sur lui-même comme une toupie» dans un sens ou dans l'autre sur sa trajectoire. Il peut prendre 2 valeurs :
s= +1/2 ou s= -1/2. On peut symboliser ces 2 valeurs par des flèches de sens contraire.
•
•
•
•
2 électrons d’un même atome ne peuvent pas avoir la même «énergie». Ils diffèrent par un nombre quantique au moins. Dans l’image de Pauli, les 3 premiers nombres quantiques (n, l, m) définissent une trajectoire sur laquelle on aura au maximum 2 électrons de spin opposés. On peut dire que les 3 premiers nombres quantiques définissent un objet mathématique appelé case quantique qui peut:
Remarques:
Cette image découle des modifications apportées au modèle de Bohr. Les électrons se trouvent sur des couches et sous-couches telles que:
1.
2.
Les électrons occupent les niveaux d’énergie les plus bas possibles. Une case quantique ne peut posséder 2 électrons que lorsque toutes celles du même niveau énergétique en possèdent déjà (règle de Hund).
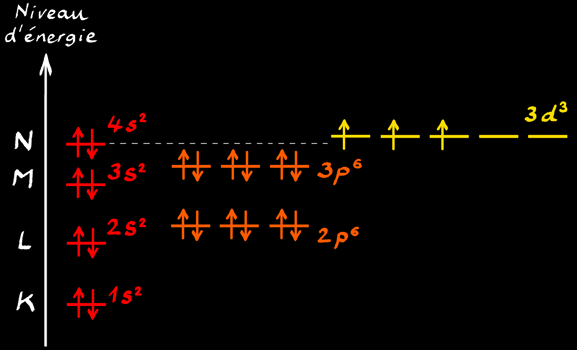
Exemple: représentation de l’élément vanadium 23V
Les 23 électrons se placent dans les cases quantiques en commençant par le niveau d’énergie le plus bas.
Représente la structure électronique du sodium, du néon,
du potassium, du chlore et du carbone.








Vérification des hypothèses de Bohr
Principe d’exclusion de Pauli
être vide
contenir 1 électron célibataire
contenir 2 électrons de spin opposés
1.
2.
3.
symbole
autre symbole
couches
C’est souvent sous cette forme que la notation électronique est donnée dans le tableau périodique.
Notation électronique :

sous-couches


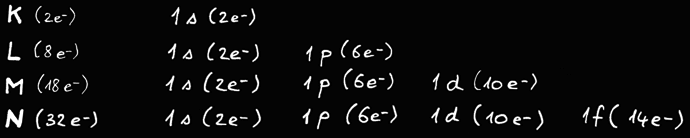






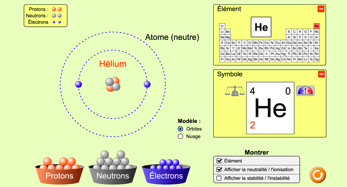
Une animation permet de «construire des atomes»
Animation «gaz»