Modèle de Bohr



En 1913, Nils Bohr propose une nouvelle image de l’atome qui s’accorde mieux avec les expériences. Il reprend l’image du modèle planétaire d'Ernest Rutherford qui décrit l'atome comme un noyau chargé positivement, autour duquel se déplacent les électrons chargés négativement. Il émet quelques hypothèses révolutionnaires:
1
2
3
4 ...
Les électrons ne peuvent pas se trouver n’importe où dans un atome. Ils tournent sur des orbites stationnaires: sur ces orbites privilégiées, les électrons ne perdent pas d’énergie. Ils devraient normalement finir leur course en chutant sur le noyau comme le voudrait la physique classique (comme les satellites autour de la Terre). Mais ce n’est manifestement pas le cas, d’où cette hypothèse.
1.
Les électrons “gravitent” sur des orbites qui correspondent à différents niveaux d’énergie discontinus. On dit que l’énergie est quantifiée.
2.


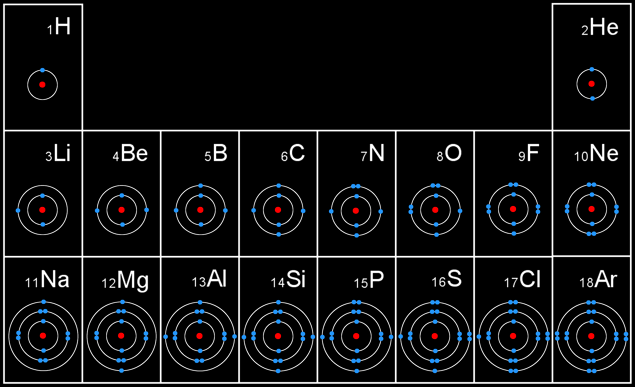
Représentation des 18 premiers éléments
I
II
III
IV
V
VI
VII
VIII
1
2
3
Remarque: Le nombre d’électron sur la dernière couche (couche périphérique) correspond au numéro de la colonne du tableau périodique où l’élément se trouve.
Le noyau au centre de l’atome est représenté en rouge. les électrons sont en bleu.



Suite du cours: l’atome



Suite du cours: le tableau périodique

Suite du cours: la liaison chimique



Retour au portail de chimie


Retour au portail des sciences








On trouve au maximum électrons par orbite.
La première orbite ( 1 ) peut contenir au maximum 2 électrons.
La deuxième orbite ( 2 ) peut contenir au maximum 8 électrons.
La troisième orbite ( 3 ) peut contenir au maximum 18 électrons.
La quatrième orbite ( 4 ) peut contenir au maximum 32 électrons.
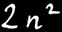
Les orbites sont numérotées : n = 1, 2, 3, 4, ... du centre vers la périphérie de l’atome.
3.
Les électrons peuvent passer d’une orbite stable à l’autre en échangeant des “paquets” d’énergie ou “quantum d’énergie” qu’on appelle photon.
4.