L’acide nitrique


L’acide nitrique HNO3 concentré réagit fortement avec une pièce de monnaie.
Comment expliquer que cet acide qui fait disparaître une pièce de monnaie en quelques secondes, ne semble pas avoir d’effet sur le verre, une matière pourtant fragile?
L’acide nitrique ronge le métal mais pas le verre



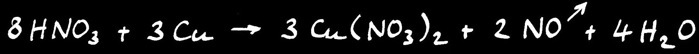
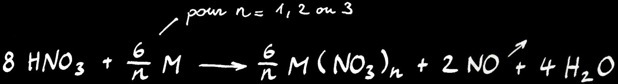


L’acide nitrique, est utilisé sous l’appellation “eau forte” pour réaliser une gravure sur cuivre. Or les pièces de monnaie sont des alliages qui contiennent du cuivre.


Par exemple, les pièces suisses de 10, 20, 50 centimes, ainsi que 1, 2 et 5 francs sont formées d’un alliage appelé cupronickel. Leur composition centésimale est de:
Cu (cuivre)
Ni (nickel)
75 %
25 %
La pièce de 5 centimes est même formée d’un alliage contenant une proportion plus grande de cuivre:
Cu (cuivre)
Al (aluminium)
Ni (nickel)
92 %
6 %
2%
L’acide nitrique est non seulement un acide mais aussi un puissant oxydant. Il est capable d’arracher des électrons aux métaux qui deviennent des ions positifs. Ceux-ci sont dissous et donnent à la solution leur couleur caractéristique. Le nitrate de cuivre est bleu et le nitrate de nickel vert. On écrit la réaction d’oxydation du cuivre par l’acide nitrique:
Le monoxyde d’azote NO dégagé réagit instantanément avec le dioxygène contenu dans l’air pour former le dioxyde d’azote NO2 de couleur orange. Attention, ce gaz est extrêmement toxique. On peut écrire l’équation suivante:
L’équation générale de la réaction entre l’acide nitrique et un métal M donnant n électrons s’écrit:


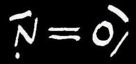

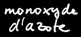
=











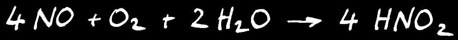











Cette page est en travaux. Bientôt la suite...



Bronze, pointe de lance, 5e siècle avant JC , Olympie



Suite du cours: la combustion
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: oxydation et réduction






