Piles et accumulateurs





Fin de la page
Suite du cours: le circuit électrique
Retour au portail des sciences

Retour au portail de l’électricité







Les piles et les accumulateurs sont des générateurs électrochimiques: ils produisent du courant électrique à partir de réactions chimiques. Ils permettent de stocker l’électricité.
Les piles sont des générateurs à usage unique: lorsque les réactifs chimiques sont consommés on dit que la pile est déchargée (ou “plate”) et il faut la changer.
Les accumulateurs sont des générateurs réutilisables. On peut recharger un accumulateur en lui redonnant l’électricité qu’il a produite. On dit que la réaction chimique est réversible.

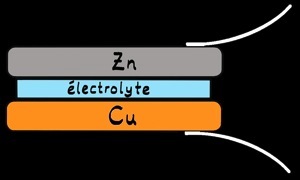
Fabrication d’une pile
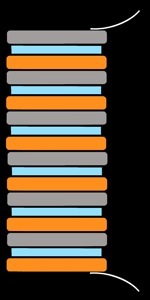
Pile au fromage (Cu / Zn)
Pile au citron (Cu / Zn) ou (Cu / Mg)
Pile à la pomme de terre (Cu / Zn)
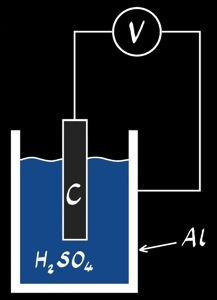
canette d’aluminium, C, H2SO4
Pile au crayon (C) et taille crayon (Mg)

La pile de Volta

La pile de Daniell

La pile saline

La pile alcaline

La pile au lithium

La pile au mercure
Retirée du marché depuis 1998 à cause de la toxicité du mercure.

La pile à hydrogène

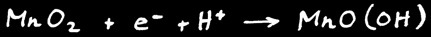


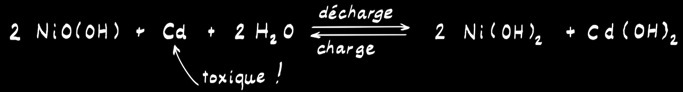
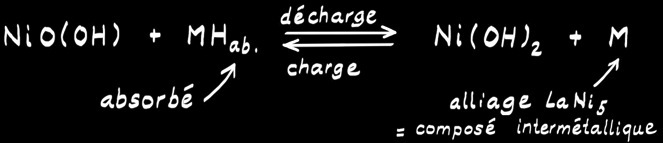
L’accumulateur Ni-Cd

L’accumulateur Ni-MH
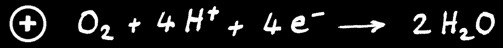

Tension nominale de 1,2 V.

Réaction globale:



La pile de Grenet
1850 électrodes de C et Zn amalgamé (Hg)
électrolyte K2Cr2O7











Retour au portail de chimie





anode au lithium (code C)
diamètre
20 mm
épaisseur
3,2 mm



tension nominale
accumulateur lithium-ion
«Piles et batteries», un film de la série «C’est pas sorcier»




cuivre (Cu)
zinc (Zn)
cuivre (Cu)
magnésium (Mg)





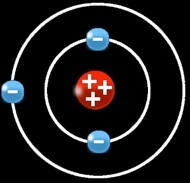
Le lithium (Li) a un numéro atomique = 3
3 protons (+) dans le noyau
2 électrons (-) sur la 1e orbite
1 électron (-) sur la 2e orbite
Ce qui signifie qu’il a :
Puisque le métal lithium a autant de charges positives (protons) que négatives (électrons) on peut dire que ces charges se compensent et que l’atome est globalement neutre.



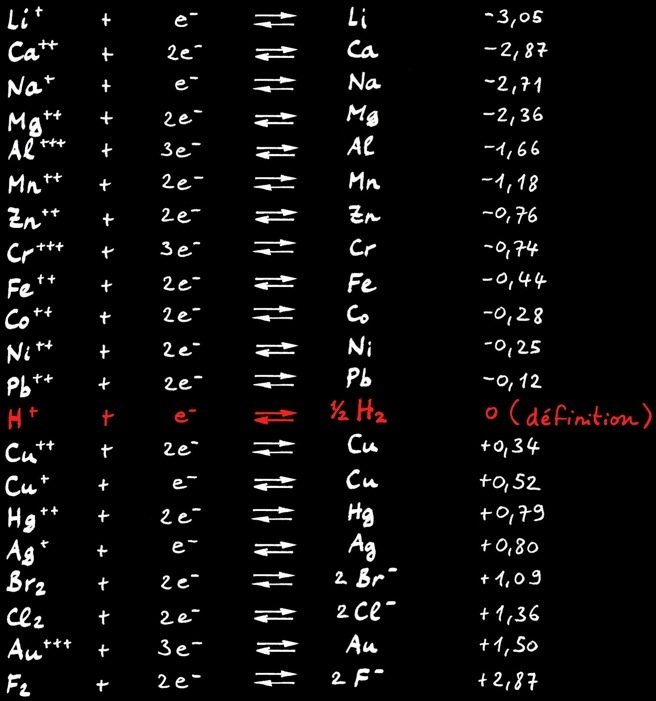



Métaux nobles
Métaux attaqués par l’ion acide H+
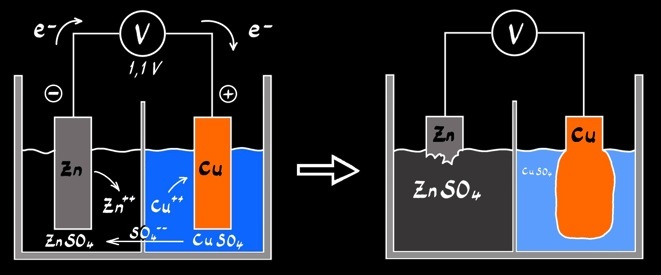


Réaction globale :
A l’anode :
A la cathode :
Réaction globale :
A l’anode :
A la cathode :
Réaction globale :
A l’anode :
A la cathode :
Réaction globale :
A l’anode :
A la cathode :
Réaction globale :
A l’anode :
A la cathode :
Réaction globale :
Réaction globale :
A l’anode :
A la cathode :
Inventée et présentée par Alessandro Volta en 1800, c’est la première pile électrique. Elle était faite d’un empilement (d’où son nom) de pièces de métal de cuivre et zinc séparés par un tissu imbibé de saumure (eau salée) qui jouait le rôle d’électrolyte. On peut aussi utiliser un électrolyte acide comme l’acide sulfurique.
Inventée par Georges Leclanché en 1867 et améliorée en 1876, la pile saline est encore utilisée de nos jours. On l’appelle aussi pile sèche, pile carbone-zinc ou pile Leclanché.
Réaction globale :
A l’anode :
A la cathode :
La pile alcaline ressemble beaucoup à la pile saline. L’électrolyte est alcalin (hydroxyde de potassium). L’électrode positive est formée de dioxyde de manganèse MnO2 . L’électrode négative est en zinc mais aussi parfois en lithium.


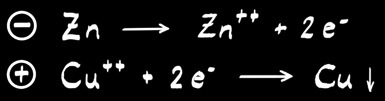

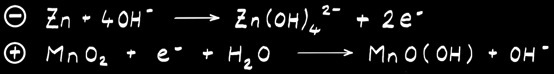
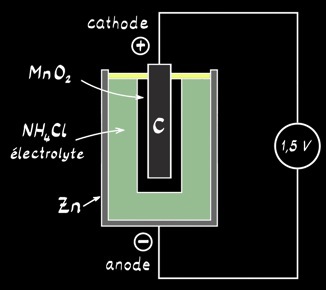
Le pôle négatif est constitué de zinc métallique (Zn) qui joue aussi le rôle de récipient.
L’électrode positive est formée de dioxyde de manganèse MnO2 en contact avec un cylindre de carbone (C).


Accumulateur au plomb
L’accumulateur au plomb est très utilisé comme batterie 12V dans les voitures. Il est constitué de 6 cellules de 2V en série qui délivrent une tension totale de 12V.


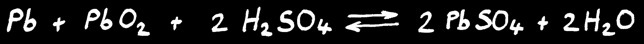
les 6 cellules sont remplies avec 6 volumes d’acide sulfurique H2SO4





pôle
pôle
Chaque cellule est le lieu d’une réaction chimique réversible:
plomb
dioxyde de plomb
acide sulfurique
sulfate de plomb
eau
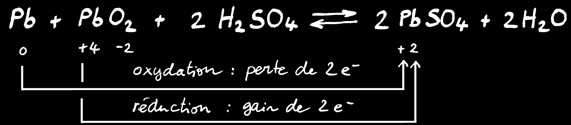
Lorsque la cellule délivre du courant électrique, c’est le plomb qui fournit les électrons au pôle négatif: il s’oxyde. Lorsque les électrons ont parcouru le circuit électrique et qu’ils reviennent dans la cellule: ils réduisent le dioxyde de plomb.



A l’anode :
A la cathode :
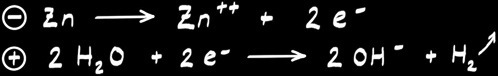


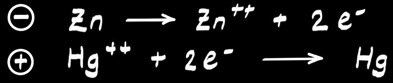
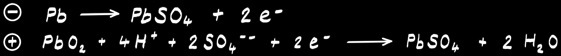

Potentiel d’oxydoréduction
Le potentiel d’oxydoréduction (ou potentiel redox) donne la tendance à attirer des électrons dans une réaction chimique. Il s’exprime en volt [ V ] par rapport à une référence: le potentiel du couple hydrogène H+ / H2.
Plus le potentiel d’une substance est élevé...
plus cette substance attire des électrons: on dit qu’elle se réduit.
•
Plus le potentiel d’une substance est faible...
plus cette substance donne des électrons: on dit qu’elle s’oxyde.
•
Tous les métaux dont le potentiel d’oxydoréduction est inférieur à zéro volt [ 0V ] sont oxydés, rouillés et rongés par les acides. En effet l’ion hydrogène H+, caractéristique des acides, est un attracteur d’électrons.
Les métaux qui résistent aux acides (métaux nobles) ont un potentiel redox supérieur à 0V.




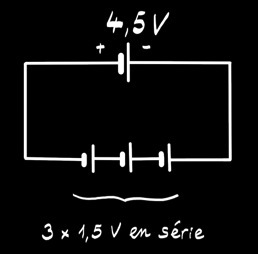
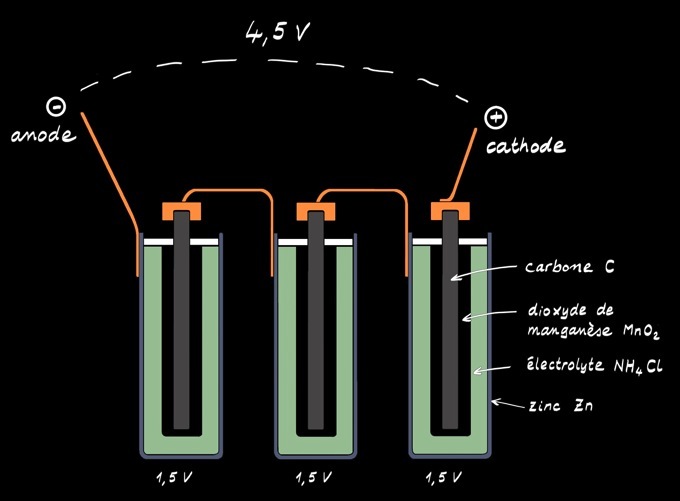
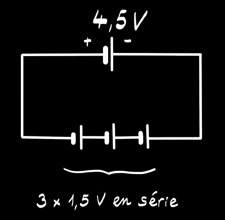
La pile alcaline 4,5V est formée de 3 piles 1,5V placées en série. On peut la représenter par le schéma:
La pile saline 4,5V est formée de 3 piles 1,5V placées en série.
On peut la représenter par le schéma:

La pile alcaline 9V est formée de plusieurs unités. Comment peut-on la représenter par un schéma ?