Tétravalence du carbone

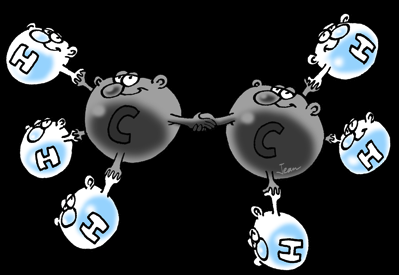

Dans tous les composés organiques le carbone est entouré de 4 liaisons covalentes. On dit qu'il est tétravalent.
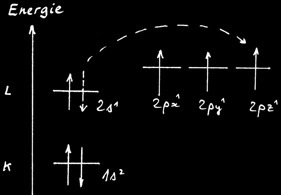
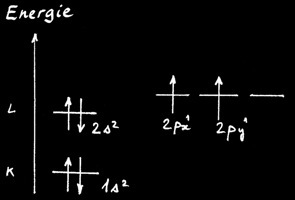
Or la structure électronique du carbone à l'état fondamental fait apparaître 2 électrons célibataires.
Pour expliquer la tétravalence du carbone il faut donc admettre qu'au moment de former des molécules le carbone redistribue ses électrons de la couche L : c'est l'état activé.
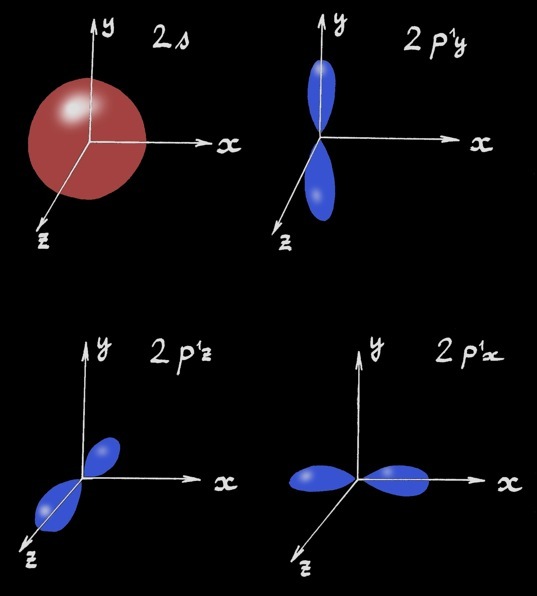
Ainsi activé le carbone possède 4 électrons célibataires: il peut ainsi former 4 liaisons covalentes. Mais ces électrons appartiennent à des orbitales de formes différentes.
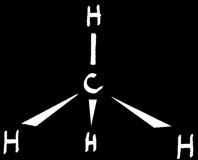
On ne peut donc pas encore expliquer que dans certains composés, les liaisons du carbone sont rigoureusement identiques: dirigées vers les sommets d'un tétraèdre régulier. C'est le cas du méthane (CH4) par exemple.
Il y a donc une autre distribution des électrons qui est décrite dans la théorie de l'hybridation des orbitales. On distingue 3 cas:
Les 3 orbitales p fusionnent avec l'orbitale s pour former 4 orbitales hybrides équivalentes dirigées vers les sommets d'un tétraèdre régulier: elles forment entre-elles des angles d'environ 109°. Schématiquement (seuls les électrons de la couche L sont représentés) nous pouvons écrire:
hybridation sp3 par fusion des orbitales
Ce type d'hybridation sp3 se rencontre dans les composés du carbone possédant des simples liaisons
Exemple : le méthane (CH4)
Exemple : l'éthane (C2H6)
Dans le C2H6, on a:
L'orbitale 2s fusionne avec 2 orbitales 2p pour former 3 orbitales hybrides équivalentes, coplanaires, formant entre-elles un angle de 120°. Il reste une orbitale 2p non hybridée perpendiculaire au plan des orbitales hybrides.
Cette hybridation se rencontre dans les composés possédant des doubles liaisons entre les atomes de carbone.
Le recouvrement latéral conduit à la formation d'une liaison caractérisée par 2 lobes de probabilité de présence des électrons de liaison: on l'appelle liaison π (pi, la lettre p en grec).
Dans C2H4 on a:
L'orbitale 2s fusionne avec 1 orbitale 2p pour former 2 orbitales hybrides équivalentes, portées par le même axe (= coaxiales). Il reste 2 orbitales 2p non hybridées.
Ce type d'hybridation se rencontre dans les composés possédant une triple liaison entre atomes de C :

L’état activé



L’hybridation sp3

L’hybridation sp2

L’hybridation sp1




Fin de la page
Suite du cours: Nomenclature
Retour au portail des sciences



Retour au portail de chimie



•
•
1 liaison σ par recouvrement axial sp3-sp3 (liaison C-C)
6 liaisons σ par recouvrement axial 1s1-sp3 (liaison C-H)
•
•
•
1 liaison σ par recouvrement axial sp2-sp2 (liaison C-C)
4 liaisons σ par recouvrement axial 1s-sp2 (liaison C-H)
1 liaison π par recouvrement latéral 2p-2p (liaison C-C)
•
•
•
2 liaisons σ par recouvrement axial sp1-1s (liaison C-H)
1 liaison σ par recouvrement axial sp1-sp1 (liaison C-C)
2 liaisons π par recouvrement latéral 2p-2p (liaison C-C)
En résumé: ..........






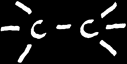


Le recouvrement axial de 2 orbitales conduit à la formation d'une orbitale moléculaire de liaison: ici une liaison σ (sigma , la lettre s en grec)
Exemple : l'éthène (ou éthylène) C2H4 CH2=CH2
Exemple: L'éthyne (ou acétylène) C2H2 ....
On a donc: