Thermochimie





Fin de la page
Retour au portail des sciences

Retour au portail de chimie









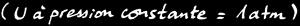

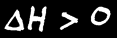


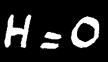

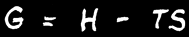

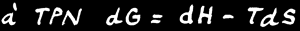

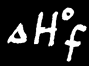



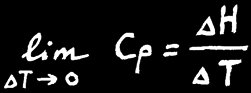
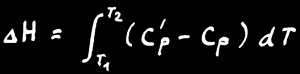
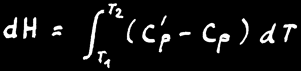

L’énergie de réaction

L’énergie de formation

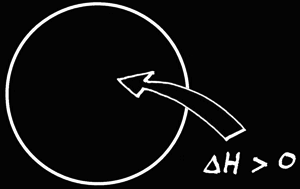
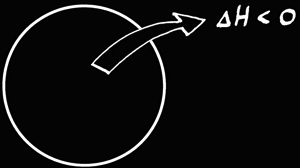
Nous avons déjà vu que derrière toutes les transformations, tous les événements, il y a une grandeur qui persiste: l'énergie. L'énergie peut exister sous différentes formes:
L'énergie chimique est contenue dans les liaisons entre atomes (liaisons ioniques, covalentes,...) et entre molécules (liaisons intermoléculaires).
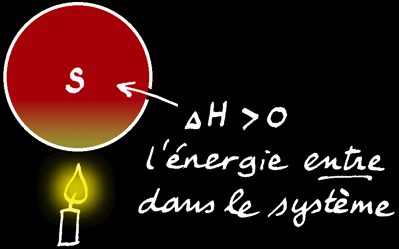
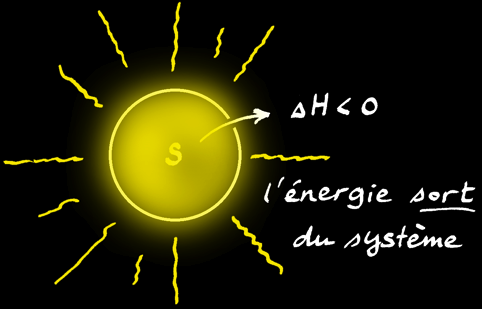
L'énergie totale d'un système chimique (symbole: U) est inconnue. Par contre on peut mesurer la quantité d'énergie qui entre ou qui sort du système et donc de la variation de l'énergie du système que l'on note ∆U.

L’enthalpie
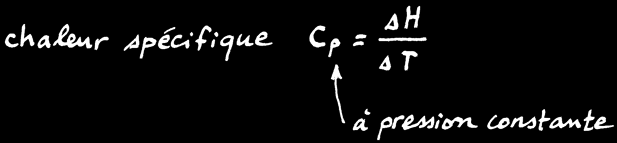
On définit l'enthalpie (symbole: H) comme l'énergie interne d'un système chimique à la pression constante de 1 atmosphère [atm] qui est une valeur idéalisée de la pression atmosphérique moyenne. C'est une grandeur très pratique pour étudier des systèmes chimiques dans des conditions terrestres.
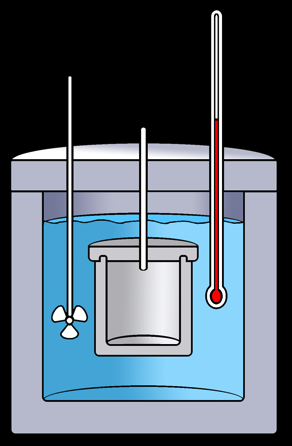
L'enthalpie d'un système n'est pas connaissable non plus mais la variation d'enthalpie (∆H) peut être mesurée à l'aide d'un calorimètre.

La loi de Hess

L’énergie libre


Suite du cours: la combustion


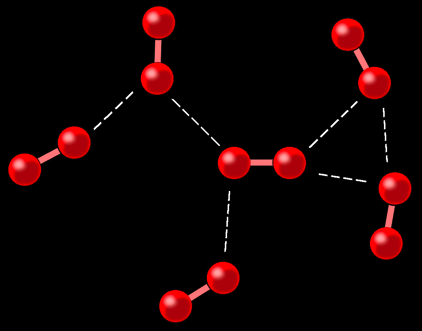
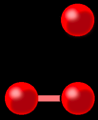
1 atome
1 molécule diatomique (formée de 2 atomes)
liaison intermoléculaire
liaison forte entre atomes


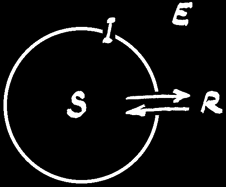




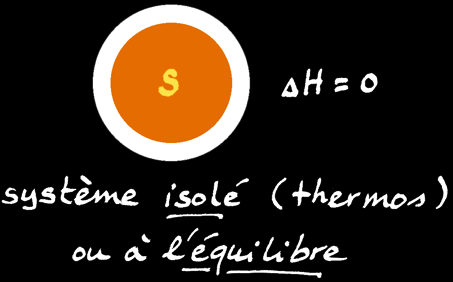
Prenons un système matériel (S) dans un environnement (E). A l’interface (I) ou à la frontière entre le système et l’environnement peuvent se produire des échanges de matière, d’énergie et d’information: un ensemble de relations (R)

pétrole brut
essence
kérozène
diesel
mazout
distillat
paraffine
soufre
résidu




Calorimétrie: combustion d’une amande


Expérience
