Les acides dans la vie





Les acides et les bases ont une grande importance. On les rencontre dans la vie de tous les jours. Différentes sciences s’y intéressent: la chimie, la biologie, la géologie, la médecine, ...
La combustion de la nourriture produit du gaz carbonique dans toutes les cellules:
C6H12O6 + 6 O2 -----> 6 CO2 + 6 H2O
Déséquilibre acide-base dans le corps humain
Lors de la digestion, les aliments sont "cassés" par des moyens mécaniques (dents) mais aussi chimiques:
CO2 dans l'air 0,035 % du volume (pas beaucoup !)
calcaire + eau acide (H2O + CO2)---dissolution ( fissures , grottes , gouffres , dolines )
---> spéléologie
évaporation eau + CO2 --- concrétion calcaire (stalagmites et stalagtites)
réaction: CaCO3 + H2O --> rien
CaCO3 + H2O + CO2 ---> Ca (HCO3-)2 ( Réaction inverse : bouilloire et stalactites )
insoluble = H2CO3 soluble
à basse pression (Patm, dépression) H2CO3 ---------> H2O + CO2
Goûter CO2 gazeux

Eau gazéifiée
eau gazéifiée frizzante
à haute pression H2O + CO2 ---------> H2CO3



Acides et métaux
Les acides peuvent attaquer les métaux. Attention dégagement de gaz dihydrogène explosif.
2 HCl + Mg -----> H2 + MgCl2

Ce dégagement de gaz H2 se note généralement avec une flèche dirigée vers le haut.
On peut aussi noter l’état des substances de l’équation: solide (s), liquide (l) et gaz (g).


Acide et calcaire
CaCO3 + 2 HCl ----> CaCl2 + H2CO3
Comme l’acide carbonique est instable à TPN il se décompose en dioxyde de carbone gazeux et en eau selon:
H2CO3 ------> H2O + CO2 (dégazage) )


Acides dans le corps humain
Les fragiles structures vivantes ne peuvent survivre que dans un environnement stable et tempéré. Des systèmes sophistiqués s'opposent aux fortes variations de température , de salinité et d'acidité imposées par le monde extérieur. Le maintien de ces conditions de vie stable s'appelle l'homéostasie.

glucose
dioxygène
eau
dioxyde de carbone

Lorsqu’on verse de l’acide chlorhydrique HCl sur une roche contenant de la calcite (calcaire, marbre, marne, certains grès,...) on constate une effervescence. La réaction s’écrit:

Influence de l'alimentation
Alcalose (trop de base): vomissement, hyperventilation.
Acidose (trop d'acide): acidose diabétique, inspiration de CO2, emphysème, dyspnée, acidose lactique (effort), insuffisance rénale,...
•
•
Attaque acide dans l'estomac. Suc gastrique pH= 1-2
Attaque basique dans l'intestin. Suc pancréatique pH 7,5-8,2
•
•
•
Production d'acides et de bases dans le corps humain

Retour au portail des sciences



Retour au portail de chimie




Suite du cours: Acides et bases


Suite du cours: les solutions





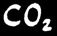
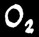
Les poumons expirent le dioxyde de carbone (gaz carbonique) produit par la combustion.

Autrement, le CO2 réagirait avec l’eau du sang et le rendrait plus acide: risque mortel d’acidose.

Les reins excrètent des substances acides ou basiques en fonction des besoins.
acide carbonique
eau
dioxyde de carbone





Fin de la page

Les acides dans le vin
Cette chromatographie sur papier permet d’analyser l’acidité de 10 cuvées de vins en cours de vinification.
Le bleu de bromothymol (BBT) est un indicateur d’acidité: il devient jaune dans un milieu acide. Les taches jaunes trahissent donc la présence de 2 acides:
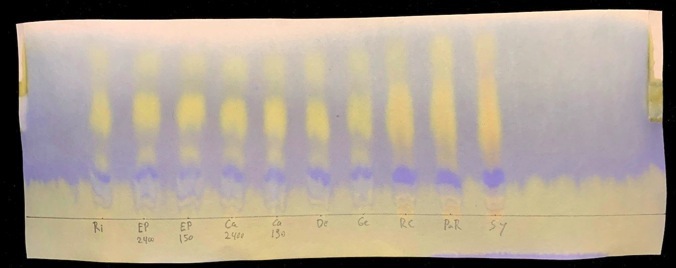
acide malique
acide lactique


L’acide malique C4H6O5 est le plus massique (134 g/mol) et le plus dense: il migre moins vite. Il possède 2 fonctions acide -COOH
L’acide lactique C3H6O3 est le moins massique (90 g/mol) et le moins dense: il migre plus vite. Il possède 1 seule fonction acide -COOH
•
•
Au cours de son développement, le vin peut subir une fermentation malo-lactique: l’acide malique (qu’on trouve dans les pommes vertes) se transforme en acide lactique: le vin devient moins acide.
