La liaison chimique

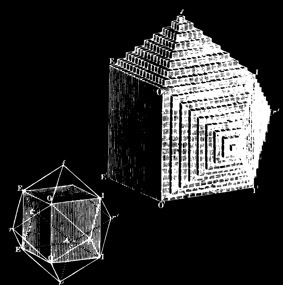
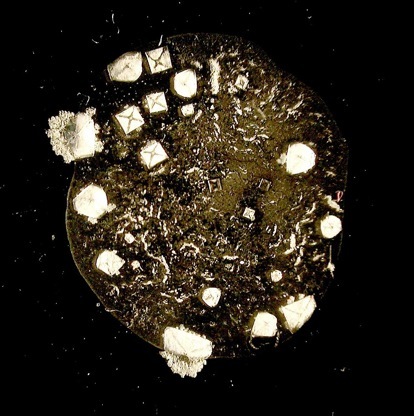
Visitez ma collection de cristaux et minéraux




Les atomes de la 8e colonne du tableau périodique (gaz rares ou gaz inertes) sont caractérisés par leur très grande inertie chimique. Ils ne réagissent pas avec les autres atomes pour former des molécules. cette inertie, autrement dit cette grande stabilité est due à la présence de 8 électrons périphériques correspondant au remplissage des couches s2p6: on dit que les éléments de la 8e colonne ont réalisé l’octet.
Pour gagner en stabilité, tous les autres atomes vont tendre à réaliser l’octet au cours de réactions chimiques avec d’autres atomes pour former des molécules ou des composés ioniques. Pour cela, ils peuvent perdre, gagner ou mettre en commun un ou plusieurs électrons.
Prenons un atome de sodium Na (on l’appelle natrium en allemand).
Exemples:
Le néon
L’argon

La liaison ionique

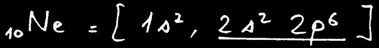

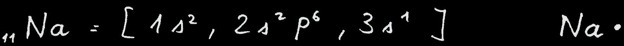
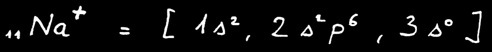
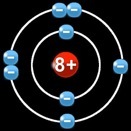
Pour réaliser l’octet, cet atome de sodium doit perdre un électron. Il acquiert ainsi la structure électronique du néon. Mais en même temps il porte une charge supplémentaire positive devenant ainsi un ion positif appelé cation.
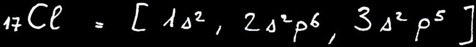
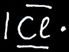

Soit un atome de chlore (Cl)
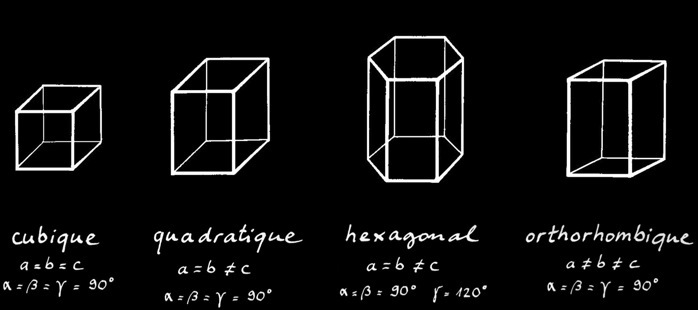
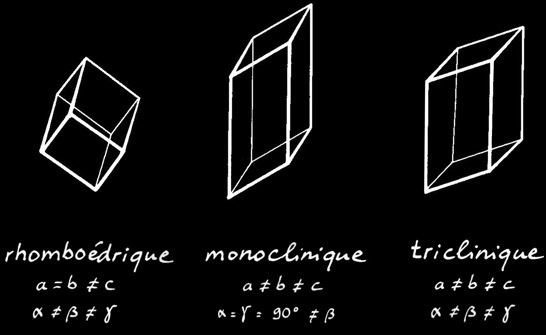
cubique quadratique hexagonal rhomboédrique orthorhombique monoclinique triclinique


Prenons le cas de SO3. Les liaisons chimiques n'ont jamais le caractère pur décrit ci-dessus: elles sont toujours hybrides.
On dit que la molécule résonne entre des formes limites (ici il y en a 3).
De même la liaison de HCl n'est ni une liaison ionique pure, ni une liaison covalente pure. On a une résonance entre 2 formes
Les % de caractère ionique sont donnés par le tableau périodique des éléments.
Pour réaliser l'octet, le chlore doit gagner un électron. Il devient ainsi un ion négatif appelé anion.
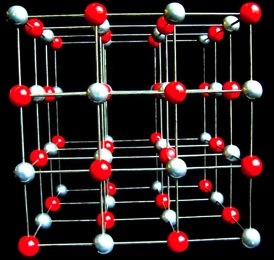
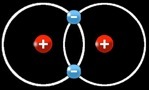
Les cations et les anions ainsi formés sont porteurs de charges opposées. Ils vont donc s'attirer pour former des composés ioniques cristallins selon le modèle suivant:
On a ici un cristal ionique de
que l'on note NaCl: c'est le chlorure de sodium ou sel de cuisine. NaCl cristallise sous la forme de petits cubes: on parle de système cristallin cubique.
Les propriétés physiques d’un cristal varient...
... quand on l’étudie sous différents angles.
On dit qu’un cristal est anisotrope: il n’a pas les mêmes propriétés dans toutes les directions de l’espace. Une matière isotrope par contre a les mêmes propriétés dans toutes les directions.





+
_
On peut donc écrire:
On peut donc écrire:


Une goutte d’eau salée grossie 20x.
Lorsque l’eau s’évapore, les ions Na+ et Cl- s’assemblent spontanément pour former des cristaux cubiques de halite (NaCl).
Il y a dans la nature 7 systèmes cristallins différents:


La liaison covalente
Prenons 2 atomes de chlore. Les 2 atomes doivent se stabiliser en trouvant un électron supplémentaire. Mais aucun des deux n'a "la force" de l'arracher à l'autre.
La liaison covalente de coordination
Prenons la molécule de SO: nous avons une double liaison covalente
Les hybrides de résonance
Modèle de cristal de NaCl
formé de 32 Na+ et de 32 Cl-
Sel de cuisine (grossi 10x)



Cette page est en travaux. Bientôt la suite...


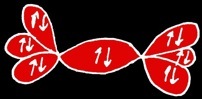

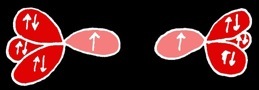
La liaison covalente résulte de la mise en commun de 2 électrons célibataires appartenant à chacun des atomes pour former une orbitale moléculaire de liaison.
Si on prend la molécule d'azote, un autre gaz diatomique (N2), les 2 atomes vont mettre en commun leurs 6 électrons célibataires pour former 3 orbitales moléculaires de liaison ou triple liaison covalente.

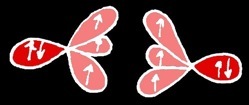





Cette molécule de SO réagit avec l'oxygène pour former du SO2:

La liaison covalente de coordination résulte de la mise en commun d'un doublet d'électrons. On la symbolise par une flèche allant du donneur (le moins électronégatif: ici le soufre) à l'accepteur (le plus électronégatif: ici l'oxygène).

Les atomes de la 8e colonne du tableau périodique (gaz rares ou gaz inertes) sont chimiquement très peu réactifs: ils ne réagissent pas avec les autres atomes pour former des molécules. Ce manque de réactivité, autrement dit cette grande stabilité est due au remplissage de la dernière couche d'électrons (les électrons périphériques).
Pour gagner en stabilité, tous les autres atomes vont tendre à s'entourer d'une couche pleine d'électrons à la périphérie. Pour cela, ils peuvent perdre, gagner ou mettre en commun un ou plusieurs électrons au cours de réactions chimiques avec d’autres atomes pour former des molécules.

La liaison covalente

La liaison ionique
La molécule de dihydrogène se forme à partir de 2 atomes d'hydrogène.
Lorsque 2 atomes se lient par liaisons covalentes , ils mettent en commun des électrons de leur dernière couche (électrons périphériques). Les non-métaux se lient entre-eux par liaisons covalentes.
La molécule de dioxygène se forme à partir de 2 atomes d'oxygène.

+

Lorsqu'un atome de chlore rencontre un atome de sodium ils se lient d'une autre façon:

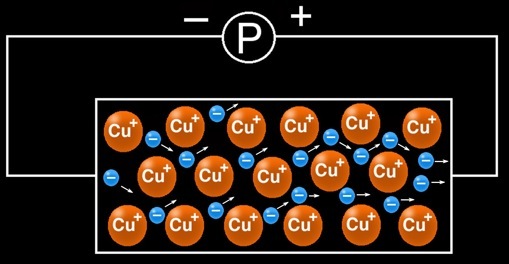
La liaison métallique
Les métaux, à gauche du tableau périodique ont tendance à se débarrasser de leurs électrons périphériques peu nombreux afin de trouver une couche pleine en dessous. Mais comme aucun atome n'accepte ces électrons, ils peuvent se "promener" librement entre les atomes. C'est pour cela que les métaux conduisent si bien l'électricité.

La liaison chimique... une autre version






+
+
_
_

Sel de cuisine (grossi 10x)
Les ions + et - s'attirent , s'empilent et forment grâce à leurs liaisons ioniques des cristaux avec leurs belles formes géométriques. Le Na+ et le Cl- par exemple forment les cristaux de sel de cuisine de forme cubique. Son nom chimique est chlorure de sodium.
Dans l'opération le chlore a gagné un électron: il devient un atome chargé, un ion négatif (ou anion) Cl-.
En même temps le sodium a perdu un électron. Comme il porte une charge supplémentaire positive (dans son noyau) il devient un ion positif : le cation Na+

+
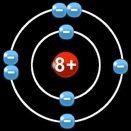

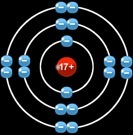
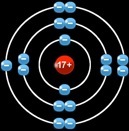
Pour se stabiliser le chlore doit gagner un électron pour remplir sa 2e couche. L'atome de sodium devrait en trouver 7 pour remplir sa 3e couche. En fait il perd un électron et retrouve sa 2e couche pleine, avec la structure électronique du néon.
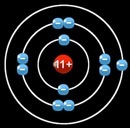
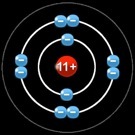
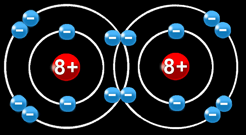
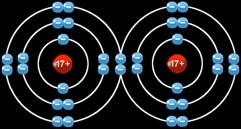
La molécule de dichlore se forme à partir de 2 atomes de chlore. Il mettent en commun 2 électrons : leur 3e couche est pleine.
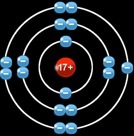
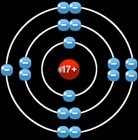
+



On peut écrire :
On peut écrire :


un électron célibataire

liaison covalente
= 2 électrons

liaison covalente double
= 2 x 2 électrons

2 électrons célibataires

On peut écrire :
On peut écrire :

+
anion
cation
attraction

donne un électron

Liaison chimique... et tableau périodique
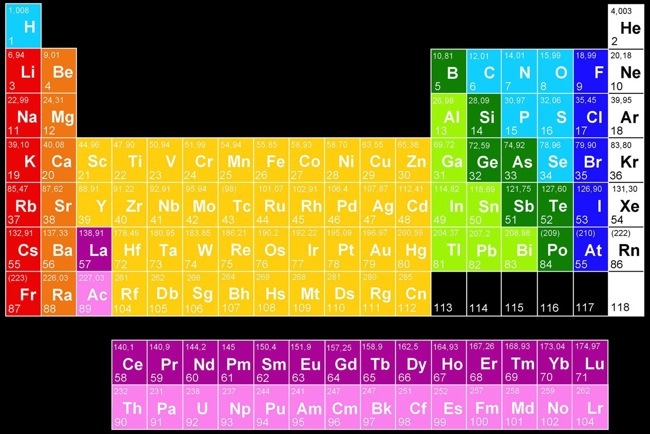









Les métalloïdes ont des propriétés intermédiaires entre les métaux et les non-métaux. Nous réglerons leur problème plus tard.
Les non-métaux (à droite du tableau) réagissent entre eux en formant des liaisons covalentes.
Les éléments de la 8e colonne (gaz rares ou gaz inertes) ont leur dernière couche électronique pleine : ils sont stables et ne forment généralement pas de liaisons chimiques.
1
2
3
4
5
6
7
8

les métaux
les non-métaux
Les métaux (à gauche du tableau) réagissent entre eux en formant des liaisons métalliques.


Les métaux réagissent avec les non-métaux en formant des liaisons ioniques.
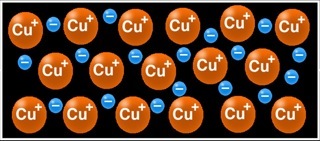
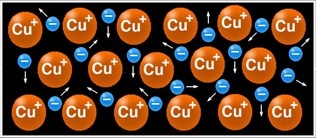
Pour simplifier, on peut se représenter un morceau de cuivre comme un empilement d’atomes avec des électrons libres dans les “interstices”.
Les électrons libres sont très mobiles et se déplacent dans tous les sens.
Si on relie ce morceau de métal aux pôles d’une pile, le mouvement désordonné des électrons fait place à un courant électrique : tous les électrons libres (chargés négativement) se dirigent vers le pôle positif de la pile.

Prenons un morceau de métal, du cuivre par exemple.
Retour au portail des sciences



Retour au portail de chimie



Suite du cours: la réaction chimique

Suite du cours: l’électronégativité









A télécharger








+
_


+



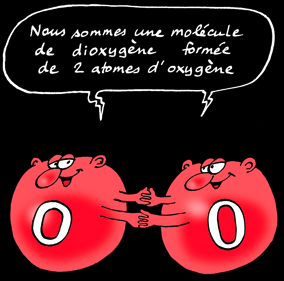
Il mettent en commun 2 électrons : leur 1ere couche est pleine.
Il mettent en commun 2 x 2 électrons : leur 2e couche est pleine.