L’oxydation






Oxydation du fer

Noter certaines propriétés de ces substances avant et après la réaction (couleur, état, poids, propriétés électriques et magnétiques,...).
Observer la réaction chimique et la décrire: couleur de la flamme, chaleur dégagée...
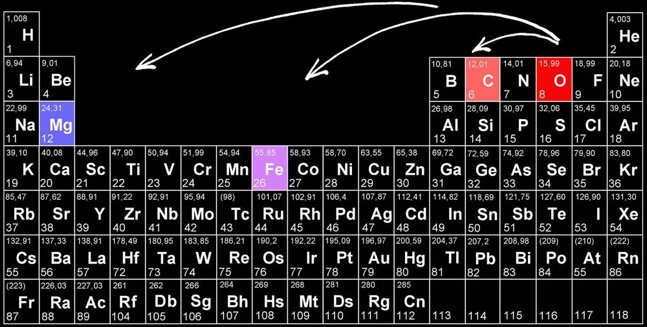
Trouver une relation entre l'énergie développée pendant la réaction et la place des différents éléments dans le tableau périodique.
ruban de magnésium (Mg)
tampon de paille de fer (Fe)
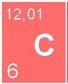
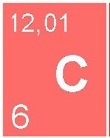
mine de crayon en graphite (C)
pince métallique
bec brûleur
pile 4,5 V
balance de précision
aimant
Peser chaque échantillon sur la balance de précision
Tester les propriétés magnétiques de chaque élément avec l'aimant
Tester les propriétés électriques (conduction de l’électricité)
Noter toutes les autres caractéristiques possibles de chaque élément (couleur, toucher,...)
Tenir chaque élément dans la flamme du bec brûleur avec la pince. Ressortir la substance dès que la réaction commence et observer en dehors de la flamme.
Noter les caractéristiques des substances après la réaction.

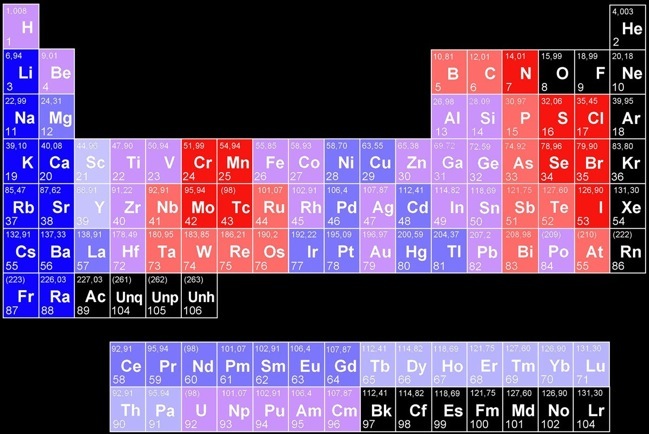








Les éléments ont des oxydes de plus en plus acides
Les éléments ont des oxydes de plus en plus basiques




2.
3.
4.
1
1
1
1
1
1
1
1
Méthode
1.
2.
3.
4.
5.
6.
7.
Matériel








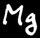
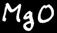


La vive lumière dégagée par l’oxydation du magnésium a été utilisée autrefois comme flash en photographie. Une ampoule à usage unique contenait un long filament de magnésium.
Remarques
1.






1.
Prendre 3 éléments solides du tableau périodique: le magnésium (Mg), le fer (Fe) et le carbone (C). Les faire réagir avec le gaz dioxygène: ils brûlent en dégageant de l’énergie. Ce sont des réactions exothermiques.






L’oxydation du carbone est très lente. Lorsqu’on éteint le bec Bunsen, la réaction s’arrête très rapidement. La couleur de la matière nous renseigne sur sa température. Le carbone réagit avec le dioxygène présent dans l’air selon l’équation:
Avant la réaction
Le fer (Fe) est un métal, gris clair, ductile, brillant, magnétique, bon conducteur électrique (la réaction est même initiée par le passage du courant).
Pendant la réaction
Le fer devient incandescent. La lumière émise va du orange-jaune jusqu’au blanc. Le fer réagit avec le dioxygène présent dans l’air selon l’équation:
Après la réaction
L’énergie d’activation (flamme ou courant électrique) ne suffit pas à provoquer une réaction complète. La réaction s’arrête d’elle-même après un certain temps hors de la flamme. Le produit de la réaction est un oxyde de fer: solide, gris bleuté, friable, de formule Fe3O4 (comme le minéral magnétite).
Avant la réaction
Le magnésium (Mg) est un métal, gris clair, ductile, brillant, non-magnétique, bon conducteur électrique.
Pendant la réaction
Le Magnésium devient incandescent. La lumière émise devient très vite blanche et aveuglante (attention les yeux). L’oxydation du magnésium est complète. L’énergie dégagée par la réaction entretient celle-ci même lorsqu’on éteint le bec Bunsen. Le magnésium réagit avec le dioxygène présent dans l’air selon l’équation:
Après la réaction
Le produit de la réaction est l’oxyde de magnésium: solide, blanc, très friable, tombe en poudre. Sa formule est MgO. La poudre blanche de MgO réagit dans l’eau pour former l’hydroxyde de magnésium qui a des propriétés basiques.
Avant la réaction
Le carbone (C) est un non-métal, gris foncé à noir, cassant, non-magnétique, conducteur électrique assez moyen.

Pendant la réaction

Une grosse masse de fer (paire de ciseaux, clou, clé) ne brûle pas facilement. Mais si l’on prend du fer en filament ou en poudre cela devient possible.
La paille de fer est en réalité de l’acier: un alliage de fer (environ 99%) et de carbone (environ 1%).
Le passage d’un courant électrique dans un conducteur produit un échauffement : c’est l’effet Joule. Nous avons vu que dans le cas d’un court-circuit, si le conducteur est très fin, l’échauffement est tel que le fil peut fondre: c’est le principe du fusible. la réaction de combustion peut même démarrer et peut provoquer un incendie.
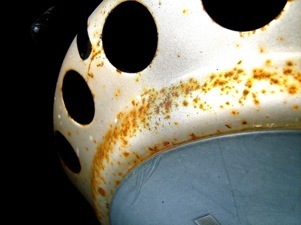
Le fer peut s’oxyder de différentes manières: il existe d’autres oxydes de fer que le Fe3O4. Un oxyde mieux connu et plus stable est le Fe2O3 qu’on appelle la rouille.
La corrosion du fer qui transforme le fer en rouille est un gros problème technique et économique. On peut essayer de protéger le fer:
Lorsque la peinture a disparu, le métal est en contact avec le dioxygène et s’oxyde.

En première approximation, les oxydes de métaux ont des propriétés basiques tandis que les oxydes de non-métaux ont des propriétés acides. On voit que c’est surtout vrai pour les métaux des deux premières colonnes. D’autres métaux, des métaux de transition comme le chrome (Cr) ou le manganèse (Mn) peuvent avoir des oxydes acides.
Métaux
Non-métaux
sens de la réaction





Résultats

la température augmente
Plus l’élément oxydé est éloigné de l’oxygène dans le tableau périodique des éléments et plus la réaction d’oxydation de cet élément est violente.

oxyde de magnésium
Fer
carbone
oxyde de magnésium


Expérience

Oxydation du magnésium

Oxydation du carbone

L’oxydation est une réaction chimique au cours de laquelle une substance perd des électrons au profit d’une autre substance (appelée oxydant). C’est souvent l’oxygène qui joue le rôle de l’oxydant.
Exemple: le carbone est oxydé par l’oxygène dans la réaction suivante.
7.
6.
5.
4.
3.
2.



filament de magnésium


Suite du cours: la combustion
Retour au portail des sciences



Retour au portail de chimie




Suite du cours: oxydation et réduction





Définition

Suite du cours: oxydation de l’hydrogène


Oxyde de fer
magnésium
hydroxyde de magnésium
dioxyde de carbone
•
•
•
•
en l’isolant de l’air au moyen d’une gaine de plastique.
en le recouvrant d’une couche de peinture.
en l’enduisant de graisse ou d’huile
en l’associant avec un autre métal plus
facilement oxydable (le magnésium par exemple).

Après la réaction
Le produit de la réaction est le dioxyde de carbone: gaz, invisible, odeur piquante, goût acide. Sa formule est CO2. Le gaz CO2 réagit avec l’eau pour former l’acide carbonique H2CO3 qui a des propriétés acides.
dioxyde de carbone
acide carbonique










Conditions d’apparition de la rouille sur un clou en acier
avec l’eau salée
Remarques


Fin de la page

Images d’oxydation
dioxyde de titane TiO2
La rouille: divers oxydes, hydroxydes et carbonates de fer
Comparer la place de chacun des éléments relativement à celle de l'oxygène dans le tableau périodique.
Nous remplissons un ballon de baudruche d’hydrogène. Le gaz est moins dense que l’air : le ballon est très léger et s’élève.
Lorsque nous approchons une allumette, le ballon explose avec un grand dégagement d’énergie sous forme de chaleur, de lumière (belle flamme orange), de bruit (explosion).

Oxydation de l’hydrogène


Fabrication d’un chalumeau oxyhydrique




L'hydrogène est un gaz di-atomique (chaque molécule de di-hydrogène H2 est composée de 2 atomes d'hydrogène H). C'est un excellent combustible: il donne beaucoup d'énergie quand il réagit avec le di-oxygène). On peut dégager toute l'énergie d'un coup (explosion) ou domestiquer cette réaction pour utiliser cette énergie (chalumeau, pile à combustible).

L’équation chimique s’écrit:


Des bulles de savon remplies d’un mélange de gaz dihydrogène (H2) et dioxygène (O2) permettent de réaliser des mini-explosions.




Système initial: les réactifs
Système final: les produits
Réaction
2 molécules de dihydrogène et
1 molécule de dioxygène
2 molécules de vapeur d’eau



